Miesto fixnej titrovateľnej kombinácie iGlarLixi v terapeutickej schéme diabetes mellitus 2. typu
Authors:
Emil Martinka
Authors‘ workplace:
Národný endokrinologický a diabetologický ústav, n. o., Ľubochňa
Published in:
Forum Diab 2019; 8(3): 185-192
Category:
Review Article
Overview
Intenzifikácia liečby bazálnym inzulínom bola donedávna možná iba pridaním prandiálneho inzulínu, čo v praxi pre pacienta znamená 4–5 injekčných podaní denne, častejší selfmonitoring glykémií, dôsledné plánovanie príjmu potravy a fyzickej aktivity vzhľadom k času a dávke podania inzulínu. V dôsledku týchto nárokov klesá záujem a adherencia pacienta k liečbe, zvyšuje sa riziko chýb a zhoršuje sa kvalita života pacientov. Po zavedení GLP1RA do liečby DM2T sa otvorila nová možnosť intenzifikácie predošlej liečby bazálnym inzulínom a pridanie GLP1RA sa stáva preferovaným spôsobom intenzifikácie pred pridávaním prandiálnych bolusov s ohľadom na individuálny terén pacienta. Klinické štúdie, ako aj klinická prax u pacientov s DM2T predtým liečených bazálnym inzulínom ukázali, že zmena za liečbu fixnou titrovateľnou kombináciou bazálneho inzulínu glargin 100 U/ml a GLP1RA lixisenatidu (iGlarLixi) v jednom dennom podaní je efektívnejšia než up-titrácia samotného bazálneho inzulínu, či pokračovanie v maximálnych dávkach samotného GLP1RA. V porovnaní s pridaním prandiálneho inzulínu v jednej, resp. troch dávkach v režime bazál-plus, resp. bazál-bolus (IIT) u pacientov predtým liečených bazálnym inzulínom s nedostatočnou glykemickou kontrolou, vedie zmena za liečbu fixnou tirovateľnou kombináciou iGlarLixi k porovnateľnej úprave parametrov glykemickej kontroly, avšak s nižším rizikom hypoglykémie, prírastku na hmotnosti a menším počtom injekčných podaní. Liečba iGlarLixi je bezpečná, dobre znášaná a s menšími nárokmi na pacienta. U pacientov s DM2T liečených bazálnym inzulínom s nedostatočnou glykemickou kontrolou je preto možné prechod na iGlarLixi považovať za preferovaný prístup intenzifikácie.
Klíčová slova:
iGlarLixi – glargin – lixisenatid
Úvod
Diabetes mellitus 2. typu (DM2T) je veľmi časté a závažné ochorenie, ktoré vedie k poškodeniu prakticky všetkých tkanív a orgánových systémov ľudského organizmu, čím významne zvyšuje morbiditu aj mortalitu pacientov. Ide o veľmi komplexné ochorenie, ktoré okrem metabolizmu glukózy zasahuje aj do ďalších pochodov intermediárneho metabolizmu. Združuje sa s obezitou, chronickým subklinickým zápalom, dyslipidémiou, inzulínovou rezistenciou, artériovou hypertenziou, dysfunkciou endotelu a ďalšími patofyziologickými odchýlkami, ktoré sú spolu s glykemickou kontrolou cieľom terapeutického snaženia. Situáciu komplikuje skutočnosť, že DM2T nie je jedno ochorenie, ale heterogénna skupina s účasťou viacerých príčinných mechanizmov v rôznom pomere zastúpenia. Navyše, s trvaním ochorenia a postupným rozvojom jednotlivých komplikácií a iných komorbidít sa významne mení aj „základný terén“ pacienta, čo vyžaduje kontinuálnu úpravu zamerania, požiadaviek, cieľov a preferencií liečby. Terapeutický prístup pri každom pacientovi s DM2T preto vyžaduje individualizáciu a obvykle kombinovanú, komplexnú liečbu s využitím účinku diétnych a režimových opatrení a farmakoterapie na úrovni viacerých účinných látok. Aktuálnou „filozofiou“ prístupu k výberu účinných látok a ich preferencie je odporúčanie založené na EBM dôkaze ich morbiditno-mortalitného alebo patofyziologického benefitu pre konkrétneho pacienta, ktorá sa aktuálne zameriava najmä na prítomnosť, dôsledky a možnosti ovplyvnenia kardiovaskulárnych ochorení a postihnutia obličiek s preferenciou inhibítorov SGLT2-kotransportu (SGLT2i) a agonistov GLP1 receptorov (GLP1RA) [3,5]. Liečba musí byť súčasne aj čo najjednoduchšia, aby vytvárala predpoklad pre adekvátnu adherenciu a komplianciu pacienta. Konečný výber často ovplyvňuje aj postoj a možnosti pacienta a znenie indikačného obmedzenia (IO), ktoré je limitom pre liečbu hradenú zo zdravotného poistenia [5].
Inzulín v skorých štádiách liečby pacientov s DM2T
U pacientov s DM2T je liečba inzulínom prirodzeným vyústením v dôsledku vývoja ochorenia, s postupným ubúdaním vlastnej sekrécie inzulínu. Hoci sa vlastná sekrécia dostáva u týchto pacientov pod hranicu, ktorú ešte považujeme za normálnu, iba výnimočne, relatívny nedostatok inzulínu k stupňu inzulínovej rezistencie sa objavuje už aj v skorších štádiách ochorenia. Kým je však potreba substitučnej liečby inzulínom v štádiu jeho nedostatku prirodzená, diskutovanou otázkou táto liečba zostáva v skorších štádiách, alebo dokonca už v čase diagnózy DM2T ako úvodnej liečby. Inzulín okrem toho, že je v rámci liečby jedinou prirodzenou a telu vlastnou látkou a najdlhšie používanou a overenou liečbou, prejavuje celý rad dôležitých biologických účinkov s komplexným benefitom. Z hľadiska patofyziológie vývoja DM2T v úvodných štádiách je dôležitá najmä skutočnosť, že inzulín šetrí vlastnú sekréciu B-buniek a spomaľuje progresiu ich dysfunkcie [5]. Z hľadiska KV-rizika je inzulín neutrálny a bezpečný.
SDS a SDiA publikovala v roku 2016 a 2018 terapeutické odporúčania, v ktorých liečbu inzulínom rozdelila do 5 oblastí, ktoré sú podrobne rozpísané v inej publikácii [5]. Najčastejším dôvodom liečby inzulínom u DM2T je zlyhanie predošlej liečby pomocou perorálnych antidiabetík (PAD), pričom najčastejšou formou iniciácie tejto liečby je podávanie bazálneho inzulínu s preferenciou bazálnych analógov prvej (galrgin 100 U/ml, Levemir) alebo druhej generácie (degludek, galrgin 300 U/ml) [5]. Znenie IO je pre bazálne analógy inzulínu u DM2T pomerne ústretové a ako podmienku vyžaduje predošlú liečbu aspoň jedným PAD v maximálne tolerovanej dávke. Umožňuje tak pridať inzulín už k predošlej liečbe metformínom [7].
Intenzifikácia predošlej liečby bazálnym inzulínom pridaním GLP1RA
Iniciálna dávka pri liečbe bazálnym inzulínom predstavuje obvykle 0,1–0,15 U/kg telesnej hmotnosti (TH) s titráciou o ± 1–2 U s frekvenciou titrácie 1–2-krát v týždni, podľa priemeru glykémie nalačno (FPG) za predošlé 3 dni, a to až do dosiahnutia požadovaného glykemického cieľa, resp. do dosiahnutia cieľovej hodnoty FPG, resp. do dosiahnutia celkovej dennej dávky cca 0,5 U/kg TH. Po dosiahnutí tejto dávky už efektivita titrácie bazálneho inzulínu obvykle výrazne klesá a zvyšuje sa riziko nežiaducich účinkov. Intenzifikácia liečby bazálnym inzulínom bola donedávna možná iba pridaním prandiálneho inzulínu, čo v praxi pre pacienta znamená 4–5 injekčných podaní denne, častejší selfmonitoring glykémií, dôsledné plánovanie príjmu potravy a fyzickej aktivity vzhľadom k času a dávke podania inzulínu. V dôsledku týchto nárokov klesá záujem a adherencia pacienta k liečbe, zvyšuje sa riziko chýb a zhoršuje sa kvalita života pacientov. Po zavedení GLP1RA do liečby DM2T sa otvorila nová možnosť intenzifikácie predošlej liečby bazálnym inzulínom a pridanie GLP1RA sa stáva preferovaným spôsobom intenzifikácie pred pridávaním prandiálnych bolusov s ohľadom na individuálny terén pacienta. Patofyziologickým argumentom pre podaní kombinácie je, že bazálny inzulín a GLP1RA účinkujú na viacerých odlišných úrovniach a vo svojich účinkoch sa výhodne dopĺňajú, resp. svoje účinky akcentujú. Hlavné z nich sú uvedené v tab. 1.
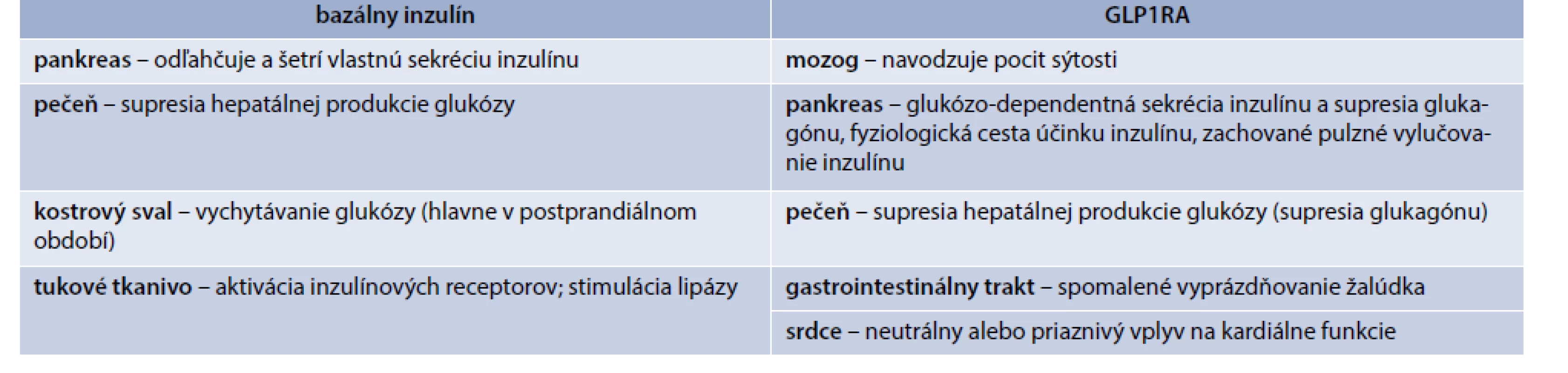
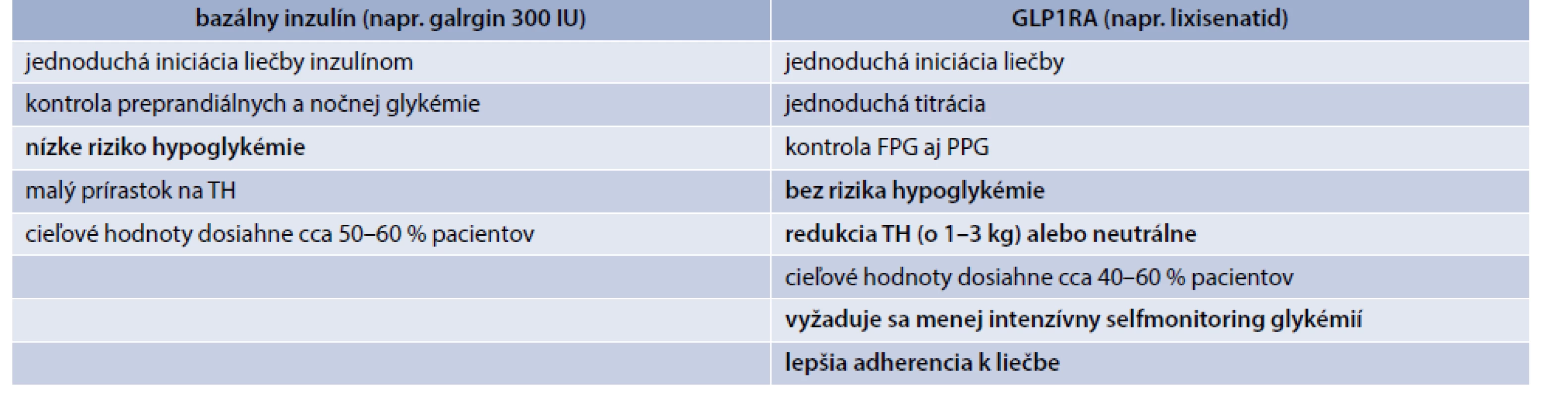
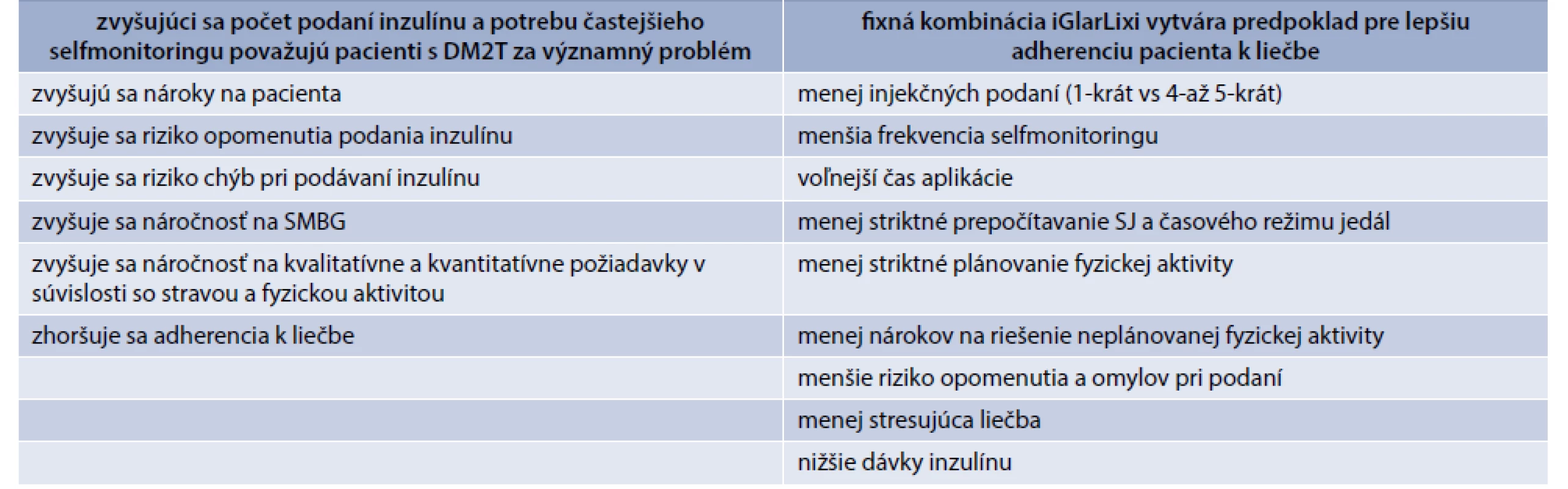
Okrem patofyziologického zdôvodnenia vychádzajú dôležité argumenty aj z bežnej klinickej praxe. V porovnaní s intenzifikáciou liečby bazálnym inzulínom pridaním prandiálnych bolusov je pri GLP1RA významne nižšie riziko prírastku na hmotnosti a hypoglykémie. Jednoduchšia je tiež iniciácia a titrácia liečby (tab. 2). Napokon, dôležitým aspektom sú aj výhody z pohľadu pacienta. Liečba je jednoduchšia, vyžaduje sa nižšia frekvencia podaní, nižšia frekvencia selfmonitoringu glykémií, menej striktné prepočítavanie sacharidov a časového zľadenia režimu jedál, menej striktné plánovanie fyzickej aktivity, menej nárokov na riešenie neplánovanej fyzickej aktivity, menšie riziko opomenutia podania a omylov pri podaní (tab. 3). To prispieva aj k zlepšeniu adherencie a kompliancie pacienta, ktoré sú v súčasnosti akcentovaným klinickým problémom. Klinický efekt liečby bazálnym inzulínom a GLP1RA zvyšuje z hľadiska adherencie k liečbe fixná kombinácia oboch účinných látok podaných v jednej injekcii 1-krát denne. V súčasnej dobe sú k dispozícii 2 takéto prípravky a to fixná kombinácia inzulínu degludek + GLP1RA liraglutidu (iDegLira), ktorá sa s úspechom používa už viac ako 2 roky, a novšia fixná kombinácia inzulínu glargin a GLP1RA lixisenatidu (iGlarLixi), ktorý je k dispozícii od 1. 7. 2019.
Fixná titrovateľná kombinácia bazálneho inzulínu glargin a GLP1RA lixisenatidu
Efektivita a bezpečnosť liečby prípravkom iGlarLixi bola hodnotená v klinickom programe Lixilan, ktorý pozostával zo štúdií Lixilan-O [9], Lixilan-L [1] a Lixilan-G [2,4,10,11]. Podporné výsledky pre použitie prípravkov v indikácii intenzifikácie predošlej liečby bazálnym inzulínom priniesli tiež výsledky programu GetGoal Duo [8] a ďalšie [6].
Lixilan–O
Cieľom štúdie LixiLan-O [9] bolo posúdiť efektivitu a bezpečnosť liečby titrovateľnou fixnou kombináciou inzulínu glargin 100 U/ml a lixisenatidu (iGlarLixi) v porovnaní s liečbou oboma komponentmi samostatne, u pacientov s DM2T nedostatočne kontrolovaných metformínom alebo kombináciou metformínu s iným perorálnym antidiabetikom (PAD). Podmienkou pre zaradenie bola predošlá liečba metformínom v trvaní minimálne 3 mesiace ± iné PAD, pri vstupnej hodnote HbA1c 7,5–10 %, ak pacient bol liečený iba metformínom samotným, alebo HbA1c ≥ 7,0 % až ≤ 9,0 %, ak bol liečený metformínom + iným PAD vrátane inhibítora DPP4 alebo SGLT2i. Po 4 týždne trvajúcej úvodnej „run-in“ fáze, počas ktorej bola optimalizovaná liečba metformínom a ukončená liečba inými PAD, bolo randomizovane zaradených 1 170 pacientov buď na liečbu iGlarLixi alebo inzulínom galrgin (iGlar), resp. lixisenatidom (Lixi) samotným, podávaných v jednom dennom podaní, s titráciou dávok s cieľom dosiahnutia glykémie nalačno < 5,6 mmol/l, do maximálnej dávky iGlarLixi a iGlar 60 U/deň a Lixi 20 μg/deň. Primárnym sledovaným parametrom bola zmena hodnoty HbA1c po 30 týždňoch liečby.
Oproti vstupnej priemernej hodnote HbA1c 8,1 % viedla fixná kombinácia iGlarLixi k signifikantne výraznejšej redukcii HbA1c vs iGlar, resp. Lixi (-1,6 %, vs -1,3 %, resp. 0,9 %), s dosiahnutím priemernej hodnoty HbA1c 6,5 % vs 6,8 %, resp. 7,3 % (v oboch prípadoch p < 0,0001). V ramene s iGlarLixi vs iGlar, resp. Lixi bol tiež významne vyšší podiel pacientov, u ktorých sa dosiahla hodnota HbA1c < 7,0 % (74 % vs 59 %, resp. 33 %; p < 0,0001) ako aj hodnota HbA1c < 6,5 % (56 % vs 40 %, resp. 19 %; p < 0,0001). V redukcii glykémie nalačno (FPG) bola efektivita iGlarLixi porovnateľná s iGlar a v oboch ramenách sa dosiahli významne nižšie hodnoty FPG než v ramene Lixi (6,4 mmol/l a 6,6 mmol/l vs 8,4 mmol/l). Naproti tomu, v redukcii postprandiálnej glykémie 2 hodiny po jedle (2hPPG) viedla liečba iGlarLixi a Lixi k významne väčšiemu poklesu než liečba iGlar (-2,3 mmol/l a -3,2 mmol/l vs -0,2 mmol/l; p < 0,0001 mmol/l).
Priemerná telesná hmotnosť v ramene s iGlarLixi poklesla o 0,3 kg, v ramene s Lixi o 2,3 kg, zatiaľ čo pri iGlar sa zvýšila o 1,1 kg s rozdielom oproti iGlarLixi o 1,4 kg; p < 0,0001. Dokumentovaná symptomatická hypoglykémia (< 3,9 mmol/l) sa vyskytla u 26 % pacientov liečených iGlarLixi a 24 % pacientov liečených iGlar, kým u pacientov liečených Lixi u 6,4 %. Vo vyjadrení príhod glykémie na pacient/roky sa v ramene s iGlarLixi, resp. iGlar jednalo o 1,4, resp. 1,2 príhody za pacient/rok), zatiaľ čo pri Lixi 0,3 príhody za pacient/rok.
Liečba bola dobre tolerovaná vo všetkých troch ramenách. Celkový výskyt nežiaducich účinkov (56,9 % vs 48,6 %, resp. 67,4 %) vrátane závažných nežiaducich účinkov (3,8 % vs 4,1 %, resp. 3,9 %) bol medzi ramenami porovnateľný. Najčastejšími nežiaducimi účinkami boli gastrointestinálne prejavy (nauzea, vracanie, hnačka), ktoré sa najčastejšie vyskytovali v ramene Lixi (iGlarLixi 1,7 %, iGlar 12,6 %, Lixi 36,9 %).
V súhrne hodnotenia výsledkov štúdie Lixilan-O je teda možné konštatovať, že liečba iGlarLixi u pacientov s DM2T nedostatočne kontrolovaných metformínom, alebo kombináciou metformínu s iným PAD sa vo väčšine sledovaných parametroch glykemickej kontroly ukázala efektívnejšia než liečba samotným inzulínom glargin 100 U/ml, resp. samotným lixisenatidom. Lepšie hodnoty HbA1c sa u vyššieho podielu pacientov liečených iGlarLixi dosiahli bez prírastku na hmotnosti a výskytu symptomatickej hypoglykémie, čo poukazuje na výhodu oproti liečbe bazálnym inzulínom samotným, u ktorého pretrváva obava z hypoglykémie či prírastku na hmotnosti, ako aj nižší výskyt nauzey a iných gastrointestinálnych prejavov oproti liečbe samotným GLP1RA, s predpokladom lepšej kompliancie. Liečbu kombináciou iGlarLixi ako iniciálnu liečbu po zlyhaní PAD však zatiaľ na Slovensku neumožňuje indikačné obmedzenie [7].
LixiLan-L
Lixilan L [1] bola randomizovaná otvorená štúdia s paralelnými skupinami. Cieľom štúdie bolo zhodnotenie efektivity a bezpečnosti liečby fixnou kombináciou inzulínu glargin 100 U/ml a lixisenatidu (iGlarLixi) vs inzulínom glargin 100 U/ml (iGlar) samotným, u pacientov s DM2T, predtým nedostatočne kontrolovaných akýmkoľvek bazálnym inzulínom, alebo v kombinácii s najviac dvoma PAD. Podmienkou pre zaradenie bola predošlá liečba bazálnym inzulínom po dobu > 6 mesiacov pri stabilnej dávke 15–40 U/deň, pri vstupnej hodnote HbA1c 7,5–10 % a glykémii nalačno ≤ 10,0 mmol/l (bazálny inzulín + 2 PAD), resp. ≤ 11,1 mmol/l (bazálny inzulín ± metformín).
Po 6 týždňov trvajúcej úvodnej „run-in“ fáze, v rámci ktorej bola začatá alebo titrovaná liečba inzulínom glargin a ukončená liečba PAD s výnimkou metformínu, ktorý bol ponechaný, bolo randomizovane zaradených 736 pacientov v pomere 1 : 1 buď na liečbu iGlarLixi alebo iGlar podávaných 1-krát denne s titráciou dávok s cieľom dosiahnutia glykémie nalačno < 5,6 mmol/l, do maximálnej dávky 60 U/deň. Primárnym sledovaným parametrom bola zmena hodnoty HbA1c po 30 týždňoch.
Počas „run-in“ fázy klesla hodnota HbA1c z 8,5 % na 8,1 %. V porovnaní s hodnotou pred randomizáciou (8,1 %), došlo v ramene s iGlarLixi k väčšiemu poklesu HbA1c než v ramene s iGlar (-1,1 % vs -0,6 %; p < 0,0001) s dosiahnutím priemernej hodnoty HbA1c 6,9 %, resp. 7,5 %. V ramene liečenom iGlarLixi bol tiež vyšší podiel pacientov, u ktorých sa dosiahla hodnota HbA1c < 7 % (55 % vs 30 %). Podobne sa pri iGlarLixi v porovnaní s iGlar dosiahol aj väčší podiel pacientov s hodnotou HbA1c < 6,5 % (34 % vs 14 %). Kým hodnoty a pokles FPG bol v oboch ramenách porovnateľný, pokles 2hPPG bol v ramene s iGlarLixi významne väčší, resp. výkyvy 2hPPG významne nižšie než v ramene s iGlar (-4,7 mmol/l vs -1,4 mmol/l, resp. -3,9 mmol/l vs -0,5 mmol/l; p < 0,0001).
Priemerná telesná hmotnosť v ramene liečenom iGlarLixi poklesla o 0,7 kg, zatiaľ čo v ramene liečenom iGlar sa zvýšila o 0,7 kg (rozdiel 1,4 kg; p < 0,0001). Výskyt dokumentovaných (< 3,9 mmol/l) symptomatických hypoglykémií bol v oboch ramenách podobný. V ramene liečenom iGlarLixi sa hypoglykémia vyskytla u 40 % pacientov a s frekvenciou 3,0 epizódy za pacient/rok, zatiaľ čo v ramene liečenom iGlar sa hypoglykémia vyskytla u 42,5 % pacientov a s frekvenciou 4,2 epizódy za pacient/rok. Podiel pacientov, u ktorých sa dosiahol HbA1c < 7 % bez prírastku na hmotnosti a bez výskytu symptomatickej hypoglykémie, bol vyšší pri iGlarLixi vs iGlar (20 % vs 9 %; p < 0,0001).
Liečba bola dobre tolerovaná v oboch ramenách. Celkový výskyt nežiaducich účinkov (53,4 % vs 52,3 %) vrátane závažných nežiaducich účinkov (5,5 % vs 4,9 %) bol medzi ramenami porovnateľný. Najčastejším nežiaducim účinkom boli gastrointestinálne prejavy, ktoré sa v ramene s iGlarLixi vyskytli u 17 % pacientiv a v ramene s iGlar u 7,9 % pacientov.
V súhrne hodnotenia výsledkov štúdia Lixilkan-L možno konštatovať, že liečba iGlarLixi je efektívnejšia než „up-titrácia“ samotného iGlar, naviac bez zvýšeného rizika prírastku na hmotnosti a hypoglykémie. Hoci, podľa očakávania, bol výskyt gastrointestinálnych prejavov v ramene s iGlarLixi častejší, len veľmi málo (1,1 %) pacientov prerušilo liečbu iGlarLixi pre nauzeu a žiaden pre vracanie či hnačku, čo sa vysvetľuje postupnou titráciou iGlarLixi. Včasná iniciácia a postupná titrácia iGlarLixi u DM2T predtým liečených bazálnym inzulínom sa tak javí výhodnejšia než ďalšia titrácia bazáleho inzulínu, a to nielen z hľadiska dosiahnutia lepších hodnôt HbA1c u vyššieho podielu pacientov s nižším rizikom hypoglykémie, ale aj z hľadiska prírastku na hmotnosti (v porovnaní s ďalšou titráciou bazálneho inzulínu) a nižším rizikom gastrointestinálnych prejavov vďaka postupnej titrácii dávky iGlarLixi.
LixiLan-G
Lixilan G [2,4,10] bola randomizovaná otvorená štúdia s paralelnými skupinami. Cieľom štúdie bolo zhodnotenie efektivity a bezpečnosti liečby fixnou kombináciou inzulínu glargin 100 U/ml a lixisenatidu (iGlarLixi) vs pokračovanie v liečbe GLP1RA u pacientov s DM2T predtým nedostatočne kontrolovaných na maximálnej dávke, denne, alebo týždenne podávaných GLP1RA s metformínom ± pioglitazón ± SGLT2i.
Pacienti boli randomizovaní v pomere 1 : 1 (257 účastníkov v každej skupine) buď do terapeutického ramena, v ktorom sa pokračovalo v liečbe GLP1RA, alebo do ramena liečeného iGlarLixi. Primárnym sledovaným parametrom bola zmena hodnoty HbA1c po 26 týždňoch. Paralelnými sledovanými parametrami bol podiel pacientov, ktorí dosiahli HbA1c < 7 %, resp. < 6,5 %, a ktorí tento cieľ dosiahli bez výskytu dokumentovanej hypoglykémie < 3,9 mmol/l, resp. < 3,0 mmol/l. Sledovala sa tiež zmena FPG a zmena 2hPPG počas „meal“ testu, miera vzostupu 2hPPG, telesná hmotnosť a parametre bezpečnosti.
Po 26 týždňov trvajúcej liečbe klesla v ramene GLP1RA hodnota HbA1c z priemernej hodnoty 7,8 % na 7,4% vs 6,7% v ramene iGlarLixi, s priemernou zmenou HbA1c o -0,4 %, resp. -1,0 % (p < 0,0001). V ramene liečenom iGlarLixi vs GLP1RA sa dosiahol aj vyšší podiel pacientov s hodnotou HbA1c < 7 % (62 % vs 26 %; p < 0,0001), resp. < 6,5 % (41 vs 10 %; p < 0,0001). Podiel pacientov, u ktorých sa dosiahol pokles HbA1c < 7,0 % bez výskytu dokumentovanej hypoglykémie < 3,0 mmol/l, predstavoval pri iGlarLixi vs GLP1RA 57 % vs 25 %, a bez výskytu dokumentovanej hypoglykémie < 3,9 mmol/l 43 % vs 25 %. Napokon, v ramene liečenom iGlarLixi bol výraznejší aj pokles FPG (-2,28 vs -0,61 mmol/l; p < 0,0001), 2hPPG (-3,94 vs -1,17 mmol/l) a postpraniálnych vzostupov glykéme.
Priemerná telesná hmotnosť v ramene liečenom iGlarLixi stúpla o 1,9 kg, zatiaľ čo v ramene s GLP1RA poklesla o 1,1 kg. Výskyt dokumentovaných symptomatických hypoglykémií (< 3,0 mmol/l) bol vyšší v ramene iGlarLixi a predstavoval 9,4 % pacientov s frekvenciou 0,25 epizódy za pacient/rok, v skupine GLP1RA predstavoval 0,4 % s frekvenciou < 0,01 epizódy za pacient/rok. Celkový výskyt nežiaducich účinkov (NU) bol v ramene iGlarLixi vyšší než v ramene GLP1RA (63,9 % vs 47,3 %), výskyt závažných NU sa však medzi skupinami nelíšil. Najčastejšie sa vyskytovali gastrointestinálne prejavy ako nauzea, hnačka, vracanie, ktoré boli častejšie u pacientov liečených iGlarLixi vs GLP1RA (21,6 % vs 10,2 % ).
V súhrne hodnotenia výsledkov štúdie Lixilan-G možno konštatovať, že u pacienta, ktorý nedosahuje cieľové hodnoty HbA1c < 7 % pri maximálne tolerovanej liečbe GLP1RA ± PAD, prispieva prechod na iGlarLixi k významnej úprave HbA1c s dosiahnutím vyššieho podielu pacientov s HbA1c < 7 % a vyššieho podielu pacientov s HbA1c < 7 % bez hypoglykémie.
GetGoal Duo-2
GetGoal Duo-2 [8] bola randomizovaná „head to head“ otvorená štúdia s troma paralelnými skupinami. Cieľom štúdie bolo zhodnotenie efektivity a bezpečnosti intenzifikácie predošlej liečby bazálnym analogom glargin ± 1–3 perorálne antidiabetiká pridaním lixisenatidu alebo inzulínu glulizin v jednej, resp. troch denných podaniach, u pacientov s DM2T s HbA1c > 7 %.
Podmienkou pre zaradenie bola liečba bazálnym inzulínom v trvaní minimálne 6 mesiacov ± 1–3 PAD.
Po 12 týždňoch optimalizácie liečby iGlar s ukončením podávania PAD okrem metformínu, ktorý bol ponechaný, došlo k poklesu HbA1c z 8,5 % na 7,9 %. Následne boli pacienti ramdomizovaní na liečbu pridaním lixisenatidu alebo glulizínu v jednej, resp. troch denných podaniach. Cieľom bolo dokázať noninferioritu liečby lixisenatidom vs glulizínom v redukcii HbA1c a superiority v zmene telesnej hmotnosti. Hodnotené boli tiež glykémia nalačno a postprandiálna glykémia, bezpečnosť a nežiadúce účinky. Po 26 týždňoch liečby došlo v ramene s lixisenatidom vs glulizínom v jednom podaní, resp. glulizínom v troch podaniach k redukcii HbA1c na 7,2 % vs 7,2 %, resp. 7,0 %. Telesná hmotnosť v ramene liečenom pridaním lixisenatidu poklesla o 0,6 kg, zatiaľ čo po pridaní inzulínu glulizin v jednom, resp. troch podaniach stúpla o 1,0 resp. 1,4 kg. Oba primárne ciele teda boli potvrdené. Symptomatické hypoglykémie boli pri liečbe lixisenatidom o 25 %, resp. 51 % menej časté než pri liečbe glulizínom v jednom, resp. troch podaniach denne, a podiel pacientov s hodnotou HbA1c < 7 % dosiahnutej bez hypoglykémie a bez prírastku na hmotnosti bol u pacientov, ktorým bol pridaný lixisenatid, vyšší než u pacientov, ktorým bol do liečby pridaný glulizín, v jednom, resp. troch podaniach [8]. Celkový výskyt nežiaducich účinkov vrátane závažných nežiaducich účinkov bol medzi skupinami porovnateľný. Najčastejšími boli gastrointestinálne prejavy, ktoré sa najčastejšie vyskytovali v ramene liečenom pridaním lixisenatidu (35,2 % vs 8,6 %, resp. 7,5 %). V súhrne hodnotenia výsledkov štúdie GetGoal Duo-2 možno konštatovať, že pridanie GLP1RA lixisenatidu je možné považovať za preferenčný spôsob intenzifikácie predošlej liečby bazálnym inzulínom pred pridaním prandiálneho inzulínu glulizín v režime bazál-plus alebo bazál-bolus, s dosiahnutím obdobných glykemických cieľov, avšak s nižším výskytom hypoglykémií a nižším prírastkom na hmotnosti.
Miesto fixnej titrovateľnej kombinácie iGlarLixi v terapeutickej schéme DM2T
Pridanie GLP1RA k liečbe bazálnym inzulínom sa ukazuje ako výhodný a preferenčný spôsob intenzifikácie predošlej liečby bazálnym inzulínom, keď v porovnaní s intenzifikáciou prandiálnym inzulínom prináša porovnateľnú glykemickú kontrolu s nižším rizikom hypoglykémie, nižším prírastkom na hmotnosti a predpokladom lepšej adherencie pacienta k liečbe vďaka menej častému podávaniu, menej častej potrebe selfmonitoringu a menej náročnému zlaďovaniu s príjmom potravy a fyzickou aktivitou. Preferencia iGlarLixi sa v tejto indikácii opiera o výsledky niekoľkých štúdií. V programe Lixilan výsledky jednotlivých štúdií ukázali, že prechod z PAD (Lixilan-O), alebo bazálneho inzulínu (Lixilan-L) alebo GLP1RA (Lixilan-G) na iGLarLixi vedie k lepšej glykemickej kontrole než liečba bazálnym inzulínom či GLP1RA samotnými, resp. ich ďalšou titráciou [1,2,4,8,10]. V štúdii GetGoal Duo2 [8] viedlo pridanie GLP1RA lixisenatidu k bazálnemu inzulínu v porovnaní s pridaním prandiálnych bolusov v režime bazál-plus alebo bazál-bolus k dosiahnutiu porovnateľných parametrov glykemickej kontroly, avšak s nižším výskytom hypoglykémie a prírastku na hmotnosti. Fixná titrovateľná kombinácia iGlarLixi nielenže si tieto výhody zachováva, ale vďaka menej frekventnému podávaniu ešte viac zvyšuje predpoklad k lepšej adherencii pacienta. Súčasne, vďaka možnosti postupnej titrácie dávok je predpoklad nižšieho rizika výskytu NÚ. Podobne iná štúdia, s využitím „propensity-score matching“ výberu pacientov s DM2T zo štúdií Lixilan-L a GetGoal Duo-2 [6] ukázala, že intenzifikácia predošlej liečby bazálnym inzulínom fixnou kombináciou iGlarLixi viedla v porovnaní s intenzifikáciou režimom bazál bolus k efektívnejšej redukcii HbA1c, poklesu telesnej hmotnosti a nižšiemu výskytu hypoglykémií, ako aj k dosiahnutiu vyššieho podielu pacientov s HbA1c < 7 % bez hypoglykémie a prírastku na hmotnosti [6]. Liečba iGlarLixi bola okrem toho jednoduchšia a pohodlnejšia než prechod režim bazál bolus. V metaanalýze literárnych zdrojov porovnávajúcej iGlarLixi s bifázickým (premixovaným) inzulínom podávaným v 2 až 3 denných podaniach, ako jeden zo spôsobov intenzifikácie predošlej liečby bazálnym inzulínom [11], bol pokles HbA1c a podiel pacientov s HbA1c < 7 % porovnateľný, avšak s nižším prírastkom na hmotnosti pri liečbe iGlarLixi [11].
Podľa SPC je „iGarLixi indikovaný v kombinácii s metformínom k liečbe dospelých pacientov s DM2T k zlepšeniu glykemickej kontroly, ak metformin samotný alebo v kombinácii s iným perorálnym antidiabetikom alebo s bazálnym inzulínom túto kontrolu nezaisťuje“ [12]. Podmienkou pre liečbu hradenú z prostriedkov zdravotného poistenia (indikačné obmedzenie) je indikácia u pacientov s nedostatočne kompenzovaným DM2T (HbA1C > 7 %), ktorí sú liečení akoukoľvek kombinovanou liečbou obsahujúcou bazálny inzulín [7], teda, ako intenzifikáciu predošlej liečby bazálnym inzulínom. Indikačné obmedzenie súčasne uvádza aj podmienku pre pokračovanie liečby, a to pokles HbA1c po 6 mesiacoch liečby aspoň o 0,5 % oproti východiskovej hodnote. Pokiaľ k tomuto poklesu nedôjde, ďalšia liečba sa nepovažuje za hradenú [7].
Dávkovanie a spôsob podávania
Suliqua je k dispozícii v 2 perách poskytujúcich odlišné možnosti dávkovania: pero Suliqua 10–40 Solostar a pero Suliqua 30–60 Solostar. Rozdiel v silách obidvoch pier spočíva v rozsahu dávok pera.
Pero Suliqua 10–40 Solostar (inzulín glargin 100 U/ml + lixisenatid 50 μg/ml) poskytuje dávkovacie jednotky od 10 do 40 jednotiek inzulínu galrgin v kombinácii s 5 až 20 μg lixisenatidu. Každá dávkovacia jednotka obsahuje 1 jednotku inzulínu galrgin a 0,5 μg lixisenatidu.
Pero Suliqua 30–60 SoloStar (inzulín glargin 100 U/ml + lixisenatid 33 μg/ml) poskytuje dávkovacie jednotky od 30 do 60 jednotiek inzulínu galrgin v kombinácii s 10 až 20 mg lixisenatidu. Každá dávkovacia jednotka obsahuje 1 jednotku inzulínu galrgin a 0,33 μg lixisenatidu [12].
Dávka lieku sa upravuje individuálne na základe klinickej odpovede pacienta a titruje sa podľa toho, koľko inzulínu pacient potrebuje. Dávka lixisenatidu sa zvyšuje alebo znižuje spolu s dávkou inzulínu galrgin a závisí od pera, ktoré sa použije [12].
Začiatočná dávka
Liečba bazálnym inzulínom alebo perorálnym antidiabetikom okrem metformínu sa musí pred začatím liečby liekom Suliqua ukončiť. Začiatočná dávka lieku Suliqua sa určí na základe predchádzajúcej antidiabetickej liečby, aby sa neprekročila odporúčaná úvodná dávka lixisenatidu 10 μg (tab. 4). Pri podávaní bazálneho inzulínu 2-krát denne alebo inzulínu glargin (300 U/ml) sa musí zvoliť začiatočná dávka lieku Suliqua tak, že predtým užívaná celková denná dávka sa zníži o 20 %. Pri akomkoľvek inom bazálnom inzulíne platí to isté pravidlo ako pre inzulín galrgin 100 U/ml. Maximálna denná dávka je 60 U inzulínu galrgin a 20 μg lixisenatidu, čo zodpovedá 60 dávkovacím jednotkám.

**pokiaľ bol používaný iný bazálny inzulín:
* v prípade bazálneho inzulínu podávaného 2-krát denne nebo inzulínu glargin (300 jednotiek/ml) je pre voľbu počiatočnej dávky prípravku Suliqua treba skôr znížiť užívanú celkovú dennú dávku o 20 %
* v prípade iného bazálneho inzulínu má platiť rovnaké pravidlo ako u inzulínu glargin (100 jednotiek/ml)
Suliqua sa má podávať 1-krát denne v priebehu 1 hodiny pred jedlom. Uprednostňuje sa podávanie každý deň pred tým istým jedlom a volí sa tak, aby to pacientovi čo najviac vyhovovalo.
Titrácia dávkovania
Dávkovanie lieku Suliqua sa musí upraviť každému pacientovi individuálne, podľa toho, koľko inzulínu potrebuje. Pri úprave dávky sa odporúča optimalizovať glykemickú kontrolu na základe glykémie nalačno. Počas prechodu na liek Suliqua a v nasledujúcich týždňoch sa odporúča dôsledné monitorovanie. Ak pacient začína s perom Suliqua 10–40 Solostar, dávka sa môže titrovať do 40 dávkovacích jednotiek. Titrácia na > 40 dávkovacích jednotiek/deň musí už pokračovať s perom Suliqua 30–60 Solostar. Ak pacient začína s perom Suliqua 30–60 Solostar, dávka sa môže titrovať až do 60 dávkovacích jednotiek. Pri celkových denných dávkach > 60 dávkovacích jednotiek/deň sa Suliqua nemôže používať. Pri indikácii liečby je podobne ako pri iných liekoch potrebné rešpektovať kontraindikácie a upozornenia uvedené v SPC (https://www.adc.sk/databazy/produkty/spc/suliqua-100-jednotiek-ml-33-mikrogramov-ml-650888.html).
Budúce perspektívy liečby fixnou titrovateľnou kombináciou iGlarLixi
Sekvenčný (postupný) vs simultánny začiatok liečby iGlarLixi
Hoci aktuálny spôsob intenzifikácie bazálneho inzulínu GLP1RA uvádzaný aj v referenčných terapeutických odporúčaniach ADA/EASD 2018 uvádza sekvenčný postup, simultánny začiatok iGlarLixi môže poskytovať viaceré výhody: oproti úvodnej liečbe inzulínom lepší efekt na 2hPPG, nižšie riziko hypoglykémie a nižšie riziko prírastku na hmotnosti; oproti samotnému GLP1RA najmä efektívnejšiu úpravu glykemických parametrov a nižšie riziko nežiaducich gastrointestinálnych účinkov. Oproti následnému pridaniu GLP1RA po predošlej liečbe bazálnym inzulínom je pri simultánnom začiatku predpoklad nižšieho prírastku na hmotnosti a nežiaducich gastrointestinálnych účinkov, vďaka nižšej dávke a postupnej titrácii iGlarLixi. Profitovať by mohli najmä pacienti s vyššou vstupnou hodnotou HbA1c a obezitou. Túto možnosť liečby zatiaľ neumožňuje indikačné obmedzenie.
Deintenzifikácia“ podávania inzulínu
Potenciálnymi kandidátmi deintenzifikačného podávania inzulínu (prechod z viacerých dávok inzulínu – MDI, resp. intenzifikovaného podávania inzulínu – IIT) na iGlarLixi sú pacienti, u ktorých bola v dôsledku aktuálnej klinickej potreby iniciovaná len prechodná (dočasná) MDI alebo IIT, pacienti s obezitou, pacienti s častejším výskytom hypoglykémií, z dôvodu horšej adherencie k liečbe pri častom podávaní inzulínu, pacienti, ktorí nie sú schopní sa vyrovnať s potrebou plánovania a počítania sacharidov a častým selfmonitoringom glykémií, ale aj dobre kontrolovaní pacienti na IIT s celkovými nízkymi dávkami inzulínu.
Záver
Intenzifikácia liečby bazálnym inzulínom bola donedávna možná iba pridaním prandiálneho inzulínu (čo v praxi pre pacienta znamená 4–5 injekčných podaní denne), častejší selfmonitoring glykémií, dôsledné plánovanie príjmu potravy a fyzickej aktivity vzhľadom k času a dávke podania inzulínu. V dôsledku týchto nárokov klesá záujem a adherencia pacienta k liečbe, zvyšuje sa riziko chýb a zhoršuje sa kvalita života pacientov. Po zavedení GLP1RA do liečby DM2T sa otvorila nová možnosť intenzifikácie predošlej liečby bazálnym inzulínom a pridanie GLP1RA sa stáva preferovaným spôsobom intenzifikácie pred pridávaním prandiálnych bolusov s ohľadom na individuálny terén pacienta.
Klinické štúdie ako aj klinická prax u pacientov s DM2T predtým liečených bazálnym inzulínom ukázali, že zmena za liečbu fixnou titrovateľnou kombináciou bazálneho inzulínu glargin 100 U/ml a GLP1RA lixisenatidu (iGlarLixi) v jednom dennom podaní je efektívnejšia než up-titrácia samotného bazálneho inzulínu, či pokračovanie v maximálnych dávkach samotného GLP1RA. V porovnaní s pridaním prandiálneho inzulínu v 1, resp. 3 dávkach v režime bazál-plus, resp. bazál-bolus (IIT) u pacientov predtým liečených bazálnym inzulínom s nedostatočnou glykemickou kontrolou, vedie zmena za liečbu fixnou tirovateľnou kombináciou iGlarLixi k porovnateľnej úprave parametrov glykemickej kontroly, avšak s nižším rizikom hypoglykémie, prírastku na hmotnosti a menším počtom injekčných podaní. Liečba iGlarLixi je bezpečná, dobre znášaná a s menšími nárokmi na pacienta. U pacientov s DM2T liečených bazálnym inzulínom s nedostatočnou glykemickou kontrolou je preto možné prechod na iGlarLixi považovať za preferovaný prístup intenzifikácie.
doc. MUDr. Emil Martinka, PhD.
Doručené do redakcie 31. 10. 2019
Prijaté po recenzii 11. 11. 2019
Sources
-
Aroda VR, Rosenstock J, Wysham C et al. Efficacy and Safety of LixiLan, a Titratable Fixed-Ratio Combination of Insulin Glargine Plus Lixisenatide in Type 2 Diabetes Inadequately Controlled on Basal Insulin and Metformin: The LixiLan-L Randomized Trial. Diabetes Care 2016; 39(11): 1972–1980. Dostupné z DOI: <http://dx.doi.org/10.2337/dc16–1495>.
-
Blonde L, Rosenstock J, Del Prato S, et al. 149-OR: LixiLan-G: A Randomized Trial Assessing Switching to iGlarLixi vs. Continuation of Daily or Weekly GLP-1RA in T2D Inadequately Controlled by a GLP-1RA and OAD(s). Diabetes 2019; 68(Supplement 1). Dostupné z WWW: <https://doi.org/10.2337/db19–149-OR>.
-
Davies MJ, D‘Alessio DA, Fradkin J et al. Management of Hyperglycemia in Type 2 Diabetes, 2018. A Consensus Report by the American Diabetes Association (ADA) and the European Association for the Study of Diabetes (EASD). Diabetes Care 2018; 41(12): 2669–2701. Dostupné z DOI: <https://doi.org/10.2337/dci18–0033>.
-
Del Prato S, Blonde L, Henry R et al. 1139-P: Influence of Screening HbA1c Levels on Glucose Control Achieved When Switching to iGlarLixi in T2D Inadequately Controlled on GLP-1 RA and OAD(s). ADA 2019, San Francisco, CA, , June 07–11. Diabetes 2019; 68(Suppl 1). Dostupné z DOI: <https://doi.org/10.2337/db19–1139-P>.
-
Martinka E, Tkáč I, Mokáň M (eds). Interdisciplinárne štandardy diagnostiky a liečby diabetes mellitus, jeho komplikácií a najvýznamnejších sprievodných ochorení. Forum Diab 2018; 7(Suppl 1): 5–153.
-
Meier J, Anderson J, Wysham C et al. Propensity-Score Matched Patient-Level Comparison of iGlarLixi and Basal-Bolus Regimen in Patients with Type 2 Diabetes. EASD 2018, Berlin, Germany, 1–5 October: Poster Event E, Thursday, 12:00–13:00. PS 065 Beta cell function and response to incretin-based therapies: 786. Dostupné z WWW: <https://www.easd.org/annual-meeting/easd-2018>.
-
MZSR. Zoznam kategorizovaných liekov 1.-31. 8. 2019. Dostupné z WWW: <https://www.health.gov.sk/Clanok?lieky201908>.
-
Rosenstock J, Guerci B, Hanefeld M et al. Prandial Options to Advance Basal Insulin Glargine Therapy: Testing Lixisenatide plus Basal Insulin vs Insulin Glulisine Either as Basal-Plus or Basal-Bolus in Type 2 Diabetes: The GetGoal Duo-2 Trial. Diabetes Care 2016; 39(8): 1318–1328. Dostupné z DOI: <http://dx.doi.org/10.2337/dc16–0014>.
-
Rosenstock J, Aronson R, Grunberger G et al. Benefits of LixiLan, a Titratable Fixed-Ratio Combination of Insulin Glargine Plus Lixisenatide, Versus Insulin Glargine and Lixisenatide Monocomponents in Type 2 Diabetes Inadequately Controlled on Oral Agents: The LixiLan-O Randomized Trial. Diabetes Care 2016; 39(11): 2026–2035. Dostupné z DOI: <http://dx.doi.org/10.2337/dc16–0917>.
-
Rosenstock J, Blonde L, Del Prato S et al. 1146-P: Switching to iGlarLixi vs Continued Treatment of GLP-1 RA: Comparative Analysis by Daily or Weekly GLP-1 RAs in the LixiLan-G. ADA 2019 San Francisco, CA, June 07–11. Diabetes 2019; 68(Suppl 1). Dostupné z DOI: <https://doi.org/10.2337/db19–1146-P>.
-
Sayre T, Shah R, Thomas J et al. Network meta-analysis of iGlarLixi, a fixed-ratio combination GLP-1 RA and basal insulin, versus insulin premix. International Diabetes Federation (IDF) Congress; 4–8 December 2017; Abu Dhabi, UAE: P-0534. Dostupné z WWW: <https://drevidence.com/network-meta-analysis-of-iglarlixi-a-fixed-ratio-combination-glp-1-ra-and-basal-insulin-versus-insulin-premix>.
-
Suliqua SPC. Dostupné z WWW: <https://www.adc.sk/databazy/produkty/spc/suliqua-100-jednotiek-ml-33-mikrogramov-ml-650888.html>.
Labels
Diabetology Endocrinology Internal medicineArticle was published in
Forum Diabetologicum

2019 Issue 3
Most read in this issue
- Kontinuálny monitoring glykémie v manažmente diabetes mellitus – pomocník pri individualizácii liečby
- Aké vysoké je v skutočnosti kardiovaskulárne riziko pri diabete 2. typu?
- Obezita, diabetes mellitus (diabezita) a kardiovaskulárne ochorenia: nebezpečná metabolická triáda
- Dulaglutid a kardiovaskulárne výsledky u pacientov s diabetom 2. typu: výsledky štúdie REWIND
