Limitácie a možná prídavná hodnota štúdií z reálnej klinickej praxe v porovnaní s randomizovanými klinickými štúdiami
Limitation and possible additive value of real world evidence in comparison with randomized clinical trials
The results of randomized clinical trials (RCTs) are the gold standard needed to approve new drugs and the new treatment indications. Their limitation is that they do not fully reflect the population of all patients in the real clinical practice due to the limitations present in the inclusion and exclusion criteria. On the other hand, the randomization process ensures an almost perfect balance between known and unknown factors that could influence the outcome of the study. In recent years, studies analyzing patients from Real World Evidence (RWE) have been increasingly published, aiming to analyze more broadly defined patient populations than those tested in RCTs. Moreover, these studies do not require a longer period of time to conduct, as they are retrospective analyses based on electronic health record databases, insurance company data and other patient registries. The randomization process is replaced by the statistical method of propensity score matching. This method has its limitations, as the factors that are taken into account when creating similar pairs of patients are defined by the investigators based on their knowledge of known confounders, i.e. those factors that may influence the outcome of the study. Thus, unlike RCTs, RWEs are also unable to stratify the study population according to previously unknown confounders. The results of several RWEs were not later confirmed in RCTs. Also, RWE-based studies conducted after RCTs, and performed on a less risky population than in RCTs, often observed a larger effect of the investigational drug than in RCTs. This finding contradicts well-known observation that the effect of a drug is greater when studied in the population with higher risk. Hence, the data obtained by such studies can be considered complementary to those obtained in RCTs. Their additive value can be used to rationalize the change of the dose of the drug or the route of administration, as well as the use of the drug in a new patient population. RWE is not suitable for demonstrating the effect or safety of a new drug, nor for comparing different groups of drugs in relation to predefined study results. These results can be considered at most hypothesis-generating and require confirmatory RCTs or indirect comparison of groups of drugs using a meta-analysis.
Keywords:
antidiabetic therapy – GLP-1 receptor agonists – randomized clinical trials – real world evidence studies – SGLT2 inhibitors
Authors:
Ivan Tkáč
Authors‘ workplace:
Excelentný tím pre výskum aterosklerózy (EXTASY), IV. interná klinika UPJŠ LF a UN LP Košice
Published in:
Forum Diab 2021; 10(Supplementum 1): 53-58
Category:
Overview
Výsledky randomizovaných klinických štúdií (Randomized Clinical Trials – RCT) sú zlatým štandardom potrebným na schválenie nových liekov a nových indikácií liečby. Ich limitáciou je, že nereflektujú úplne populáciu všetkých pacientov v reálnej klinickej praxi vzhľadom na obmedzenia prítomné v inklúznych a exklúznych kritériách. Na druhej strane proces randomizácie zabezpečuje takmer úplnú rovnováhu medzi známymi a neznámymi faktormi, ktoré by mohli ovplyvniť výsledok štúdie. V posledných rokoch sú čoraz viac publikované štúdie analyzujúce pacientov z reálnej klinickej praxe (Real World Evidence – RWE), ktorých cieľom je analyzovať širšie definované populácie pacientov, ako boli testované v RCT. Navyše, tieto nevyžadujú na vykonanie dlhšie časové obdobie, keďže ide o retrospektívne analýzy založené na databázach elektronických záznamov pacientov, údajoch poisťovní a iných registrov pacientov. Proces randomizácie sa nahradzuje štatistickou metódou párovania na základe podobnosti (propensity score matching). Táto metóda má svoje obmedzenia, keďže faktory, ktoré sú zobrané do úvahy pri vytváraní podobných dvojíc pacientov, sú definované investigátormi na základe vedomostí o známych mätúcich faktoroch (confounders), teda tých faktoroch, ktoré môžu ovplyvniť výsledok štúdie. Na rozdiel od RCT, RWE nie sú schopné rozdeliť skúmanú populáciu aj podľa doteraz neznámych mätúcich faktorov. Výsledky viacerých štúdií typu RWE neboli potvrdené v RCT. Taktiež štúdie na báze RWE vykonané po RCT na menej rizikovej populácii ako v RCT pozorovali často väčší efekt sledovaného lieku ako v RCT. To odporuje všeobecne známemu pozorovaniu, že efekt lieku je tým vyšší, čím rizikovejšia je populácia, v ktorej sa skúma. Z toho vyplýva, že dáta získané takýmito štúdiami je možno považovať za komplementárne k dátam získaným v RCT. Ich prídavná hodnota môže byť využitá pri zmene dávky lieku alebo spôsobu podávania, ako aj použitia lieku v novej populácii pacientov. Štúdie typu RWE nie sú vhodné na dôkaz účinku alebo bezpečnosti nového lieku, ani na porovnávanie jednotlivých skupín liekov vo vzťahu k predefinovaným výsledkom štúdií. Tieto výsledky môžu byť považované maximálne za hypotézu generujúce a vyžadujú následné potvrdenie RCT alebo nepriame porovnanie skupín liekov za použitia metaanalýzy.
Klíčová slova:
agonisty GLP1-receptorov – antidiabetická liečba – inhibitory SGLT2 – randomizované klinické štúdie – štúdie typu RWE
Randomizované klinické štúdie
Randomizované klinické štúdie (Randomized Clinical Trials – RCT) boli v posledných 25 rokoch zlatým štandardom na vyhodnocovanie efektivity a bezpečnosti nových liekov a následne ich schvaľovanie regulačnými agentúrami pre použitie v klinickej praxi. Od roku 2008 sa rutinne vyžadujú aj postregistračné štúdie kardiovaskulárnej bezpečnosti pre nové antidiabetiká. Táto požiadavka bola nastolená, pretože metaanalýza štúdií niektorých novo schválených antidiabetík ako rosiglitazón ukázala zvýšené riziko kardiovaskulárnych príhod [1].
V poslednom desaťročí boli publikované viac ako dve desiatky štúdií kardiovaskulárnej bezpečnosti s novými preparátmi zo skupín inhibítorov dipeptidylpeptidázy 4 (DPP4i), agonistov receptorov pre glukagónu podobný peptid 1 (GLP1-RA), inhibítorov sodíkoglukózového kotransportéra 2 (SGLT2i), ako aj nových depotných inzulínov glargín a degludek. Prakticky všetky tieto štúdie ukázali kardiovaskulárnu (KV) bezpečnosť vyššie uvedených skupín preparátov. Navyše, viaceré preparáty zo skupín SGLT2i [2] a GLP1-RA [3] dokázali aj schopnosť prevencie kardiovaskulárnej morbidity a mortality.
RCT sú finančne veľmi nákladné a táto ich nákladnosť sa premieta do ceny nových liekov, ktorých využívanie môže byť v rozličných krajinách následne limitované rozmanitými preskripčnými obmedzeniami. Preto sa posledných rokoch objavuje trend nahradiť aspoň čiastočne RCT analýzami existujúcich veľkých databáz elektronických kariet pacientov, zdravotných poisťovní a národných registrov pacientov s diabetom. Súhrne sa tieto dáta označujú ako dôkazy z reálneho sveta klinickej praxe – Real World Evidence (RWE).
Pri analýze dát získaných observáciou klinickej praxe je najväčším problémom existencia mätúcich premenných (confounding variables). O týchto premenných je známe, že korelujú s výsledkom štúdie. Príkladom môže byť vyšší vek, o ktorom je známe, že tesne koreluje s KV-morbiditou a mortalitou. Ak teda podávame určitú študijnú medikáciu 2 skupinám chorých, ktoré majú rozličný vek, môžeme pozorovať dva typy chybných výsledkov. Skupina s nižším vekom môže mať nižšiu incidenciu KV-príhod. Ak je to skupina, ktorá dostáva študijnú medikáciu, môžeme pozorovať falošne pozitívny výsledok, ktorý bol spôsobený nie skúšaným liekom, ale nižším vekom sledovaných pacientov. A naopak, ak má nižší vek skupina dostávajúca placebo, nemusíme pozorovať efekt sledovaného lieku, aj keď tento v skutočnosti existuje, pretože je maskovaný efektom vyššieho veku skupiny dostávajúcej študijnú medikáciu. Mätúce premenné sú teda zdrojom skreslenia výsledku štúdie, pre ktoré sa v odbornej literatúre používa anglický termín bias, čo sa do slovenčiny najčastejšie prekladá ako „skreslenosť, predpojatosť, zaujatosť“.
Problém mätúcich premenných rieši dizajn RCT. Proces randomizácie – teda náhodného rozdelenia pacientov do skupín – vedie k rovnováhe mätúcich premenných v porovnávaných skupinách, či už známych alebo neznámych, takže jediným rozdielom medzi skupinami je alokácia pacientov k liekovej alebo inej intervencii. Ak RCT spĺňajú nasledovné 3 kritériá, je možné všetky rozdiely vo výsledkoch medzi skupinami prisúdiť sledovanej intervencii. Prvým kritériom je, aby študijná populácia bola dostatočne veľká na to, aby nedošlo k nerovnováhe mätúcich premenných náhodne spôsobenej. Druhým kritériom je používanie analýz typu umýsel liečiť (intention-to-treat), pri ktorej je efekt intervencie analyzovaný u každého pacienta nezávisle od adherencie k intervencii alebo liečbe ďalšími preparátmi. Posledným kritériom je sledovanie účastníkov štúdie až do konca jej trvania, a to aj tých, ktorí prestali užívať študijnú medikáciu [4]. Je potrebné dodať, že drobné nerovnováhy, ktoré v procese randomizácie vzniknú medzi porovnávanými skupinami, sú ešte štatisticky korigované za použitia viacrozmernej logistickej regresnej analýzy, ktorá simuluje stav úplnej rovnováhy medzi meranými charakteristikami skupín.
Dôkazy z reálnej klinickej praxe
Štúdie založené na analýze dát z klinickej praxe predchádzali randomizované štúdie. Často išlo o porovnanie nového typu liečby s historickými kontrolami, ktoré sa prácne dohľadávali v klasických papierových chorobopisoch. To bolo zaťažené viacerými chybami, keďže aj známe mätúce premenné často v chorobopisoch nebolo možné dohľadať. Tieto štúdie boli preto zaťažené extrémnym biasom, čo viedlo pred polstoročím k začatiu využívania RCT. Medzi prvé RCT patrila aj štúdia porovnávajúca efekt rôznych antidiabetík na rozvoj komplikácií diabetu známa ako University Group Diabetes Program [5].
V poslednom desaťročí dochádza k čoraz častejšiemu publikovaniu dát založených na RWE. To bolo umožnené elektronizáciou zdravotníctva, keď mnohé dáta je možné dohľadať z elektronických databáz ambulantných aj hospitalizovaných pacientov, národných registrov diabetikov, ako aj z databáz poisťovní sledujúcich preskripciu jednotlivých liekov. Ďalším pomerne potentným, i keď nie všemocným nástrojom pri analýze týchto dát je štatistická metóda propensity score matching (párovanie na základe podobnosti). Metóda umožňuje vytvárať podobné páry pacientov na základe predefinovaných známych mätúcich premenných, ktorých často bývajú až desiatky. Na rozdiel od randomizácie neumožňuje vytvorenie prakticky identických porovnávaných skupín aj na základe doteraz neznámych mätúcich faktorov. Keďže často je presný mechanizmus účinku nových liekov málo objasnený, nerovnováha týchto doteraz neznámych mätúcich faktorov v porovnávaných štúdiách môže významným spôsobom ovplyvniť výsledky štúdie, čo je aj jednou z hlavných limitácií tejto štatistickej metódy.
Je potrebné uviesť, že mätúce premenné s veľkou pravdepodobnosťou nedokážu skresliť výsledky s extrémne nízkym alebo vysokým relatívnym rizikom, ako je zníženie pod 0,25 alebo zvýšenie nad 4,0. V takýchto situáciách zvyčajne RCT nie sú potrebné na dokázanie kauzality. Ako príklad môže slúžiť liečba diabetickej ketoacidózy inzulínom, ktorý je bezpochyby efektívny v tejto indikácii. Relatívne riziko medzi 0,5–2,0, ktoré býva najčastejšie referované pri analýzach typu RWE, je najcitlivejšie na nespoznané mätúce faktory [4].
Príklady nezhôd medzi výsledkami RWE a RCT
Vychádzajúc z princípu, že liečebný efekt určitého lieku je tým väčší, čím vyššie je bazálne riziko, je potrebné pri porovnávaní výsledkov RWE a RCT brať do úvahy bazálne riziko vyjadrené incidenciou sledovaných výsledkov. Keďže v štúdiách založených na RWE sú často zahrnuté viaceré lieky z jednej liekovej skupiny, vhodné je porovnávanie s metaanalýzami štúdií z danej liekovej skupiny, ak sú k dispozícii.
V roku 2016 po publikovaní troch RCT, v ktorých DPP4i neboli efektívnejšie ako placebo v prevencii KV-príhod [6], boli publikované výsledky štúdie na báze RWE využívajúce na analýzy švédsky register preskribovaných liekov, register príčin smrti a národný register pacientov. Primárne boli na analýzu použité Coxové modely prežívania. Autori zistili, že u pacientov liečených primárne metformínom pridanie derivátov sulfonylurey bolo v porovnaní s pridaním DPP4i spojené so zvýšeným rizikom fatálnych a nefatálnych kardiovaskulárnych ochorení – pomer rizík (Hazard Ratio) – HR 1,17 (95% CI 1,01–1,37) a celkovej mortality – HR 1,25 (95% CI 1,12–1,38, p = 0,003). Podrobnejšia analýza výsledkov uvedená v suplementárnych tabuľkách ukázala, že zvýšené riziko mortality v porovnaní s DPP4i (80 % pacientov užívalo sitagliptín) bolo pozorované iba pre liečbu glibenklamidom (HR 1,37; 95% CI 1,11–1,69), čo súviselo pravdepodobne s 3-násobne zvýšeným rizikom rozvoja závažnej hypoglykémie. Liečba glipizidom ani glimepridom nebola asociovaná ani so signifikantne zvýšeným rizikom závažnej hypoglykémie, ani so signifikantne zvýšeným rizikom celkovej mortality [7]. Analogicky v roku 2019 publikovaná štúdia CAROLINA, ktorá priamo porovnávala preventívny efekt DPP4i linagliptínu a sulfonylureového derivátu glimepiridu v prevencii KV-príhod, nezistila žiadny rozdiel medzi týmito preparátmi [8].
Rovnaká skupina autorov porovnávala DPP4i s inzulínom ako druholíniovú liečbu pridávanú k metformínu. Tentokrát použili na analýzu metódu párovania na základe skóre podobnosti. U pacientov, ktorí dostali v inzulín glargín ako liek 2. línie, bola zvýšená celková mortalita takmer o 70 % v porovnaní s chorými, ktorí mali pridaní k liečbe DPP4i (HR 1,67; 95% CI 1,51–1,85) [9]. Tieto výsledky sú opäť v rozpore s výsledkami RCT ORIGIN, v ktorej bol skúmaný efekt titrácie glargínu v porovnaní so štandardnou antidiabetickou liečbou na rozvoj KV-príhod u pacientov s diabetom a prediabetom. V štúdii ORIGIN nebolo pozorované žiadne zvýšenie primárnych ani sekundárnych KV-výsledkov, a teda ani celkovej mortality (HR 0,98; 95% CI 0,90–1,08) u pacientov randomizovaných na liečbu glargínom v porovnaní s pacientmi na štandardnej liečbe [10].
Príchod SGLT2i do klinickej praxe vzbudil veľké nádeje, keď prvá publikovaná štúdia EMPA-REG OUTCOME pozorovala zníženie celkovej mortality o 32 % pri prídavnej liečbe empagliflozínom v porovnaní s placebom [11]. RCT s ďalšími derivátmi SGLT2i síce replikovali efekt gliflozínov na zlyhávanie srdca, neboli však schopné replikovať efekt na KV - a celkovú mortalitu [2].
Sledovať efekt na celkovú mortalitu, čo je ukazovateľ na rozdiel od iných spoľahlivo identifikovateľný aj z dabatáz, sa pokúsili dve štúdie typu RWE, v ktorých boli pacienti liečení prevažne inými preparátmi zo skupiny SGLT2i ako empagliflozínom. V štúdii EASEL 58 % diabetikov užívalo kanagliflozín, 26 % empagliflozín a 16 % dapagliflozín. Metódou párovania na základe podobnosti bolo pozorované až 43 % zníženie celkovej mortality (HR 0,57; 95% CI 0,49–0,66) u pacientov užívajúcich prídavnú liečbu SGLT2i vs nonSGLT2i, čo zodpovedalo absolútnej mortalite 12,9 vs 22,6/1 000 pacientorokov (PR) [12]. Veľmi podobná redukcia mortality o 44 % pri liečbe gliflozínmi bola pozorovaná aj v ďalšej štúdii charakteru RWE pod názvom CVD-REAL, v ktorej užívalo 53 % pacientov kanagliflozín a 41 % dapagliflozín [13].
Na výrazne odlišné výsledky medzi RCT a RWE vo vzťahu k celkovej mortalite v štúdiách s gliflozínmi poukázal kanadský bioštatistik Samy Suissa z McGillovej Univerzity v Montreale. Podľa jeho názoru rozdiel je spôsobený tzv. immortal time bias (bias obdobia nesmrteľnosti). Tento bias je zreteľný v dizajne štúdie EASEL, v ktorej boli noví pacienti liečení SGLT2i, ale mohli byť predtým liečení inými liekmi definovanými v štúdii ako nonSGLT2i. Takto sa k novšej liečbe SGLT2i dostali len pacienti, ktorí prežili obdobie liečby inými preparátmi, a preto sa nazýva táto perióda obdobím nesmrteľnosti. Pacienti, ktorí boli predtým na iných liekoch a neprežili obdobie nesmrteľnosti, sa berú ako kontroly voči pacientom užívajúcim SGLT2i, čo falošne zvyšuje hlavne rozdiely v mortalite. V štúdii EASEL ešte aj po párovaní na základe skóre podobnosti užívalo v skupine liečenej SGLT2i 23 % inzulín v porovnaní so 17 % v skupine nonSGLT2i. GLP1-RA užívalo 20 % v skupine SGLT2i a 8 % v skupine nonSGLT2i, zatiaľ čo DPP4i užívalo 58 % v skupine SGLT2i v porovnaní s 30 % pacientov liečených nonSGLT2i. Bias obdobia nesmrteľnosti tak viedol k nadhodnoteniu mortality v kontrolnej skupine neužívajúcej inhibítory SGLT2i [14]. Podobne boli ovplyvnené biasom obdobia nesmrteľnosti aj vyššie spomínané porovnania DPP4i s derivátmi sulfonylurey a inzulínom [15].
Na základe RCT iba dve skupiny nových liekov ukázali schopnosť redukcie KV-morbidity a mortality, a to SGLT2i a GLP1-RA [2,3]. Kým SGLT2i pôsobia hlavne hemodynamicky cez ovplyvnenie srdcového zlyhávania a progresie chronickej obličkovej choroby [2], GLP1-RA pravdepodobne pleiotropným efektom spomaľujú rozvoj a progresiu aterosklerózy [16]. Zatiaľ nebola vykonaná RCT, ktorá by priamo porovnávala tieto dve skupiny liekov, ale máme dostatok dát, ktoré umožňujú porovnanie na základe metaanalýz.
Longato et al z Univerzity v Padove sa pokúsili porovnať uvedené skupiny antidiabetík v populácii Benátska a z oblasti severozapadného Talianska. V rámci štúdie charakteru RWE za použitia párovania na základe podobnosti zistili signifikantne nižší výskyt niektorých KV-výsledkov u pacientov užívajúcich SGLT2i v porovnaní s pacientmi užívajúcimi GLP1-RA. Z SGLT2i boli v tom období v Taliansku používané preparáty dapagliflozín, empagliflozín a kanagliflozín, zatiaľ čo z GLP1-RA boli užívané lixisenatid, liraglutid, exenatid a dulaglutid. V tab. 1 sú zhrnuté tieto výsledky a sú porovnané s metaanalýzami štúdií s SGLT2i a GLP1-RA. Autori ako primárnu analýzu používali princíp as treated (na liečbe), teda boli zahrnutí len pacienti, ktorí liečbu neprerušili. To nebolo v súlade so správnou štatistickou praxou hodnotenia výsledkov klinických štúdií, v ktorých sa ako primárna má vykonávať analýza na princípe úmysel liečiť, čo znamená, že do výsledkov štúdie sa zarátavajú aj pacienti, ktorí liečbu prerušili z akýchkoľvek dôvodov. Autori uverejnili aj túto analýzu ako analýzu senzitivity a jej výsledky uvádzame v tab.
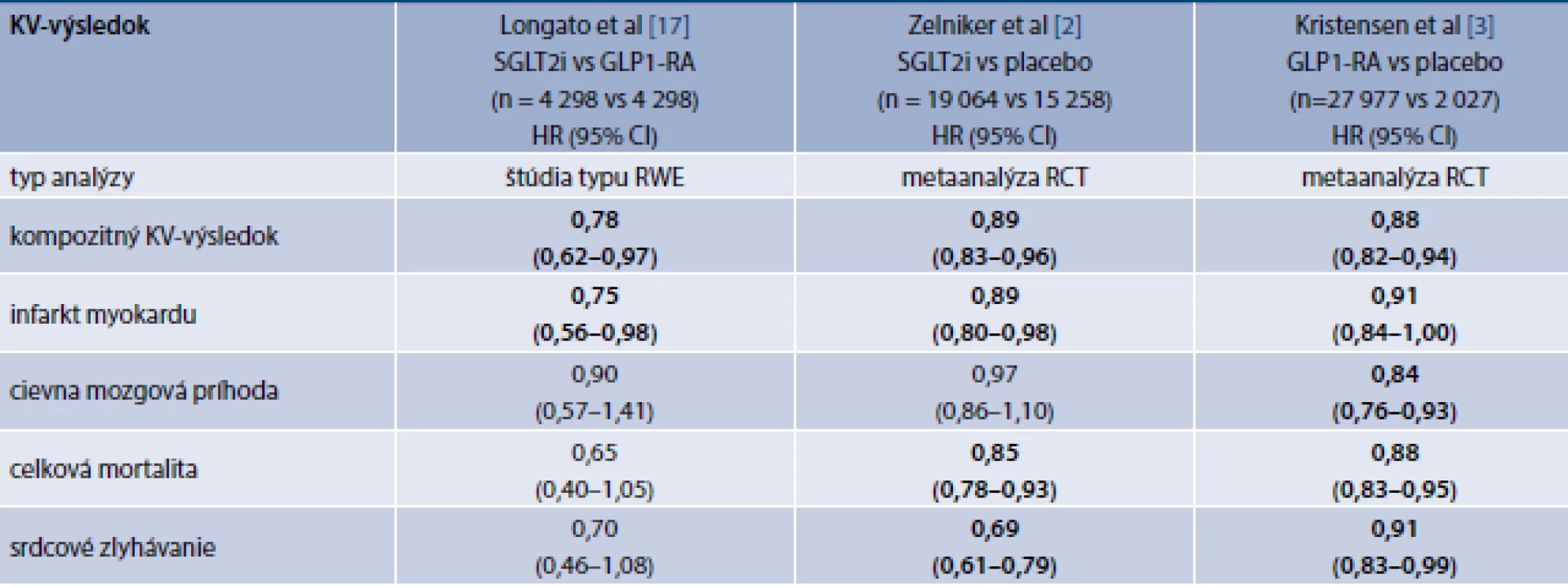
Poznámka: Kompozitné KV-výsledky v metaanalýzach boli definované ako KV-mortalita, nefatálny infarkt myokardu alebo nefatálna mozgová porážka. V článku Longato et al bol kompozitný výsledok definovaný ako celková mortalita, infarkt myokardu alebo mozgová porážka.
Tučným písmom sú vyznačené signifikantné rozdiely.
V severotalianskej štúdii bola zistená signifikantne nižšia incidencia kompozitného KV-výsledku (infarkt myokardu, mozgová porážka alebo celková mortalita) o 22 % u pacientov liečených SGLT2i v porovnaní s chorými liečenými GLP1-RA [17]. Pre porovanie, metaanalýza RCT porovnávajúcich SGLT2i s placebom ukázala signifikantne nižšiu incidenciu kompozitného KV-výsledku o 11 % [2], zatiaľ čo metaanalýza štúdií porovnávajúcich GLP1-RA s placebom zaznamenala signifikantné zníženie tohto výsledku o 12 % [3]. V štúdii Longata et al bola incidencia infarktu myokardu u pacientov na SGLT2i o 25 % nižšia ako pri liečbe GLP1-RA [17]. Toto zistenie taktiež nezodpovedalo výsledkom metaanalýz s týmito skupinami liekov, pri ktorých bolo pozorované zníženie incidencie infarktu myokardu o 11 % pri liečbe SGLT2i [2] a o 9 % pri liečbe GLP1-RA [3] v porovnaní s placebom. Incidencia cievnych mozgových príhod, celkovej mortality a srdcového zlyhávania sa v talianskej štúdii signifikantne nelíšila medzi dvomi porovnávanými skupinami liekov [17]. Na základe metaanalýz je však možné pozorovať kvantitatívne vyšší efekt GLP1-RA na incidenciu cievnych mozgových príhod – signifikantná redukcia 16 % pri liečbe GLP1-RA v porovnaní s placebom [3] a nesignifikantná redukcia pri liečbe SGLT2i v porovnaní s placebom o 3 %. Srdcové zlyhávanie však účinnejšie ovplyvňujú SGLT2i, ktoré podľa výsledkov metaanalýzy viedli k signifikantnej redukcii jeho incidencie o 31 % v porovnaní s placebom [2], zatiaľ čo GLP1-RA viedli tiež k signifikantnej redukcii srdcového zlyhávania v porovnaní s placebom, ale iba o 9 % [3]. Čo sa týka celkovej mortality, tá síce v talianskej štúdii nebola signifikantne nižšia u pacientov liečených SGLT2i v porovnaní s liečenými GLP1-RA (HR 0,65; 0,40–1,05) [17], avšak hodnota pomeru rizík bola numericky nižšia ako hodnota zistená metaanalýzou štúdií s SGLT2i (HR 0,85; 0,78–0,93) [2].
Nedávno publikovaná dánska štúdia porovnávala dáta týkajúce sa efektívnosti SGLT2i a GLP1-RA v klinickej praxi na základe viacerých národných registrov: Registračný systém občanov, Národný register preskripcie liekov, Dánsky národný register pacientov, ktorý zahrňuje informácie o diagnózach všetkých pacientov prepustených z nemocníc, ako aj Dánsky národný register príčin smrti. Boli analyzované dáta z rokov 2013–2015. Podobne ako v spomínanej talianskej štúdii boli zahrnutí do analýz diabetici s prvou preskripciou exenatidu, lisixenatidu, liraglutidu alebo dulaglutidu zo skupiny GLP1-RA (n = 8 913) a porovnávaní s pacientmi s prvou preskripciou empagliflozínu, kanagliflozínu alebo dapagliflozínu zo skupiny SGLT2i (n = 5 275). Na rozdiel od vyššie uvedenej talianskej štúdie nebol v dánskej štúdií pozorovaný žiadny rozdiel v incidencii kompozitného KV-výsledku (infarkt myokardu, mozgová porážka alebo celková mortalita), v incidencii jeho jednotlivých zložiek, ani v incidencii hospitalizácií pre srdcové zlyhávanie [18].
Výrazná nezhoda výsledkov talianskej štúdie s výsledkami dánskej štúdie a hlavne z výsledkami metaanalýz RCT oboch skupín liekov naznačuje existenciu podobných typov biasov, ktorými boli poznačené predchádzajúce štúdie typu RWE EASEL a CVD-REAL [12,13]. Z týchto biasov je potrebné zdôrazniť hlavne neschopnosť štúdií typu RWE vytvoriť rovnováhu v porovnávaných skupinách týkajúcu sa neznámych mätúcich faktorov, ako aj líšiace sa časové faktory nasadenia liekov vedúce k immortal time bias (bias obdobia nesmrteľnosti). Navyše skupina bioštatitikov z Harvardovej univerzity v Bostone poukázala na fakt, že minimálne variácie kritérií používaných na definíciu kontrolnej populácie viedli k veľkým posunom v demografickej štruktúre kohorty a následne aj k odlišným výsledkom štúdie [19].
Regulačné agentúry Food and Drug Administration (FDA) a European Medicines Agency (EMA) v posledných rokoch zvažujú, za akých okolností by mohli byť použité dáta získané na základe RWE pri schvaľovaní nových liekov a ich indikácií [20]. Keďže ide v zásade o observačné štúdie, dáta získané takýmito štúdiami je možno považovať iba za komplementárne k dátam získaným v RCT. Ich prídavná hodnota môže hlavne byť indikáciou zmeny dávky lieku alebo spôsobu podávania, ako aj použitia lieku v širšie definovanej populácii pacientov. Dáta získané za pomoci RWE v súčasnej podobe nie sú vhodné na dôkaz účinku alebo bezpečnosti nového lieku, ani na porovnávanie jednotlivých skupín liekov. Takéto výsledky môžu byť považované maximálne za hypotézu generujúce a vyžadujú potvrdenie následným RCT alebo nepriame porovnanie liekov za použitia metaanalýzy [21].
Táto publikácia bola podporená grantom VEGA 1/0183/20. IT obdržal honoráre za prednáškovú alebo konzultačnú činnosť od spoločností Boehringer Ingelheim GmBH, Eli Lilly & Comp a Novo Nordisk Slovakia. Za posudzovanie grantových návrhov obdržal honoráre od Európskej komísie – Direktoriátu pre vedu, Grantovej agentúry Českej republiky a Agentúry pre vedu a výskum MŠVVŠ Slovenskej republiky.
Sources
- Nissen SE, Wolski K. Effect of rosiglitazone on the risk of myocardial infarction and death from cardiovascular causes. N Engl J Med 2007; 356(24): 2457–2471. Dostupné z DOI: <https://doi: 10.1056/NEJMoa072761>.
- Zelniker TA, Wiviott SD, Raz I et al. SGLT2 inhibitors for primary and secondary prevention of cardiovascular and renal outcomes in type 2 diabetes: a systematic review and meta-analysis of cardiovascular outcome trials. Lancet 2019; 393 (10166): 31–39. Dostupné z DOI: <https://doi: 10.1016/S0140–6736(18)32590-X>.
- Kristensen SL, Rørth R, Jhund PS et al. Cardiovascular, mortality, and kidney outcomes with GLP-1 receptor agonists in patients with type 2 diabetes: a systematic review and meta-analysis of cardiovascular outcome trials. Lancet Diabetes Endocrinol 2019; 7(10): 776–785. Dostupné z DOI: <https://doi: 10.1016/S2213–8587(19)30249–9>.
- Gerstein HC, McMurray J, Holman RR. Real-world studies no substitute for RCTs in establishing efficacy. Lancet 2019; 393(10168): 210–211. Dostupné z DOI: <https://doi: 10.1016/S0140–6736(18)32840-X>.
- University Group Diabetes Program. A study of the effects of hypoglycemic agents on vascular complications in patients with adult-onset diabetes: II. Mortality results. Diabetes 1970; 19(Suppl 2): 785–830.
- Zheng SL, Roddick AJ, Aghar-Jafar R et al. Association between use of sodium-glucose cotransporter 2 inhibitors, glucagon-like peptide 1 agonists, and dipeptidyl peptidase 4 inhibitors with all-cause mortality in patients with type 2 diabetes: A systematic review and meta-analysis. JAMA 2018; 319(15): 1580–1591. Dostupné z DOI: <https://doi: 10.1001/jama.2018.3024>.
- Eriksson JW, Bodegard J, Nathanson D et al. Sulphonylurea compared to DPP-4 inhibitors in combination with metformin carries increased risk of severe hypoglycemia, cardiovascular events, and all causes mortality. Diabetes Res Clin Pract 2016; 117 : 39–47. Dostupné z DOI: <https://doi: 10.1016/j.diabres.2016.04.055>.
- Rosenstock J, Kahn SE, Johansen OE et al. Effect of linagliptin vs glimepirid on major adverse cardiovascular outcomes in patients with type 2 diabetes. The CAROLINA randomized trial. JAMA 2019; 322(12): 1155–1166. Dostupné z DOI: <https://doi: 10.1001/jama.2019.13772>.
- Nyström T, Bodegard J, Nathanson D et al. Second line initiation of insulin compared with DPP-4 inhibitors after metformin monotherapy is associated with increased risk of all-cause mortality, cardiovascular events, and severe hypoglycemia. Diabetes Res Clin Pract 2017; 123 : 199–208. Dostupné z DOI: <https://doi: 10.1016/j.diabres.2016.12.004>.
- Gerstein HC, Bosch J, Dagenais GR. [The ORIGIN Trial Investigators]. Basal insulin and cardiovascular and other outcomes in dysglycemia. N Engl J Med 2012; 367 : 319–328. Dostupné z DOI: <https://doi: 10.1056/NEJMoa1203858>.
- Zinman B, Wanner C, Lachin JM et al. Empagliflozin, cardiovascular outcomes and mortality in type 2 diabetes. N Engl J Med 2015; 373(22): 2117–2128. Dostupné z DOI: <https://doi: 10.1056/NEJMoa1504720>.
- Udell JA, Yuan Z, Rush T et al. Cardiovascular outcomes and risks after initiation of a sodium glucose cotransporter 2 inhibitor. Results from the EASEL population-based cohort study (Evidence for Cardiovascular Outcomes with Sodium Glucose Contrasporter 2 Inhibitors in the Real World). Circulation 2018; 137(14): 1450–1459. Dostupné z DOI: <https://doi: 10.1161/CIRCULATIONAHA.117.031227>.
- Cavender MA, Norhammar A, Birkeland K et al. SGLT-2 inhibitors and cardiovascular risk. An analysis of CVD-REAL. J Am Coll Cardiol 2018; 71(22): 2498–2506. Dostupné z DOI: <https://doi: 10.1016/j.jacc.2018.01.085>.
- Suissa S. Reduced mortality with sodium-glucoes cotransporter-2 inhibitors in observational studies. Avoiding immortal time bias. Circulation 2018; 137(14): 1432–1434. Dostupné z DOI: <https://doi: 10.1161/CIRCULATIONAHA.117.032799>.
- Suissa S. Lower risk of death with SGLT2 inhibitors in observational studies: Real or bias? Diabetes Care 2018; 41(1): 6–10. Dostupné z DOI: <https://doi: 10.2337/dc17–1223>.
- Drucker DJ. The ascending GLP-1 road from clinical safety to reduction of cardiovascular complications. Diabetes 2018; 67(9): 1710–1719. Dostupné z DOI: <https://doi: 10.2337/dbi18–0008>.
- Longato E, Di Camillo B, Sparacino G et al. Cardiovascular outcomes of type 2 diabetic patients treated with SGLT-2 inhibitors versus GLP-1 receptor agonists in real life. BMJ Open Diab Res Care 2020; 8(1): e001451. Dostupné z DOI: <https://doi: 10.1136/bmjdrc-2020–001451>.
- Nørgaard CH, Starkopf L, Gerds TA et al. Cardiovascular outcomes with GLP-1 receptor agonists versus SGLT-2 inhibitors in patients with type 2 diabetes. Eur Heart J Cardiovasc Pharmacother 2021. Dostupné z DOI: <https://doi: 10.1093/ehjcvp/pvab053>. Ahead of print.
- Huang Y, Yuan W, Kohane IS, Beaulieu-Jones BK. Illustrating potential effects of alternate control populations on real-world evidence-based statistical analysis. JAMIA Open 2021; 4(2): 1–9. Dostupné z DOI: <https://doi: 10.1093/jamiaopen/ooab045>.
- U.S. Food & Drug Administration. Framework for FDA’s Real-World Evidence Program. December 2018. Dostupné z WWW: <https://www.fda.gov/media/120060/download>.
- Collins R, Bowman L, Landray M et al. The magic of randomization versus the myth of real-world evidence. N Engl J Med 2020; 382(7): 674–678. Dostupné z WWW: <https://doi: 10.1056/NEJMsb1901642>.
Labels
Diabetology Endocrinology Internal medicineArticle was published in
Forum Diabetologicum

-
All articles in this issue
- Súčasné možnosti prevencie aterosklerózy pri diabete
- Antidiabetická liečba v prevencii aterosklerózy: posledné desaťročie
- Hypolipidemická liečba v prevencii aterosklerózy u diabetikov
- Antihypertenzívna liečba v prevencii aterosklerózy u diabetikov
- Antiagregačná liečba v prevencii aterosklerózy u diabetikov
- Efekt antidiabetickej liečby na incidenciu cievnych mozgových príhod u pacientov s diabetom 2. typu
- Limitácie a možná prídavná hodnota štúdií z reálnej klinickej praxe v porovnaní s randomizovanými klinickými štúdiami
- Fakty na zapamätanie: Čo je založené na dôkazoch v prevencii aterosklerózy pri diabete 2. typu?
- Antidiabetická liečba v prevencii aterosklerózy: prvé polstoročie
- Forum Diabetologicum
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Hypolipidemická liečba v prevencii aterosklerózy u diabetikov
- Limitácie a možná prídavná hodnota štúdií z reálnej klinickej praxe v porovnaní s randomizovanými klinickými štúdiami
- Antiagregačná liečba v prevencii aterosklerózy u diabetikov
- Antidiabetická liečba v prevencii aterosklerózy: posledné desaťročie
