Osteoporóza pri endokrinopatiách
Osteoporosis in endocrinopathies
Osteoporosis is now recognized, together with cardiovascular and oncology diseases as a civilization disease. It represents a significant growing, worldwide health problem. The high incidence of osteoporosis and fractures contribute significantly to morbidity, mortality and increased health care costs. We can divide osteoporosis in two main groups – primary and secondary osteoporosis. Secondary osteoporosis is due to a known or yet unidentified (asymptomatic) disease or long-term treatment, adversely affecting bone metabolism. So in primary osteoporosis as well as in the secondary osteoporosis it is usually a disorder associated with changes in hormone activity. The most common is the primary estrogen-deficient postmenopausal osteoporosis. However, osteoporosis is caused by a disorder of secretion of cortisol, growth hormone, thyroid, parathyroid or impaired secretion or insulin action. Except antiporotic treatment in all cases must be treated also the hormone disorder. The authors provide an overview of the root causes of endocrine conditional osteoporosis, its etiopathogenesis, clinical manifestations, diagnosis and treatment of basic principles.
Keywords:
endocrinopathies – hormonal changes – osteoporosis
Autoři:
Juraj Payer; Peter Jackuliak
Působiště autorů:
V. interná klinika LF UK a UNB, Nemocnica Ružinov, Bratislava
Vyšlo v časopise:
Forum Diab 2021; 10(1): 4-9
Kategorie:
Prehľadové práce
Souhrn
V klinickej praxi patofyziologicky rozlišujeme primárnu a sekundárnu osteoporózu. Sekundárna osteoporóza je spôsobená známym alebo dosiaľ nezisteným (asymptomatickým) ochorením alebo dlhodobou liečbou, ktorá nepriaznivo ovplyvňuje kostný metabolizmus. Tak u primárnej osteoporózy ako aj u sekundárnej sa zvyčajne jedná o poruchu spojenú so zmenou aktivity hormónov. Najčastejšou je primárna estrogén-deficientná postmenopauzálna osteoporóza. Avšak osteoporóza je spôsobená aj poruchou sekrécie kortizolu, rastového hormónu, hormónov štítnej žľazy, parathormónu, či poruchou sekrécie alebo účinku inzulínu. S výnimkou postmenopauzálnej osteoporózy je základom terapie úprava sekrécie hormónov, doplnená adekvátnou suplementáciou vitamínu D a vápnika. Autori poskytujú prehľad základných príčin endokrinne podmienenej osteoporózy, jej etiopatogenézy, klinickej manifestácie, diagnostiky a základné princípy liečby.
Klíčová slova:
endokrinopatia – osteoporóza – zmeny hormónov
Úvod
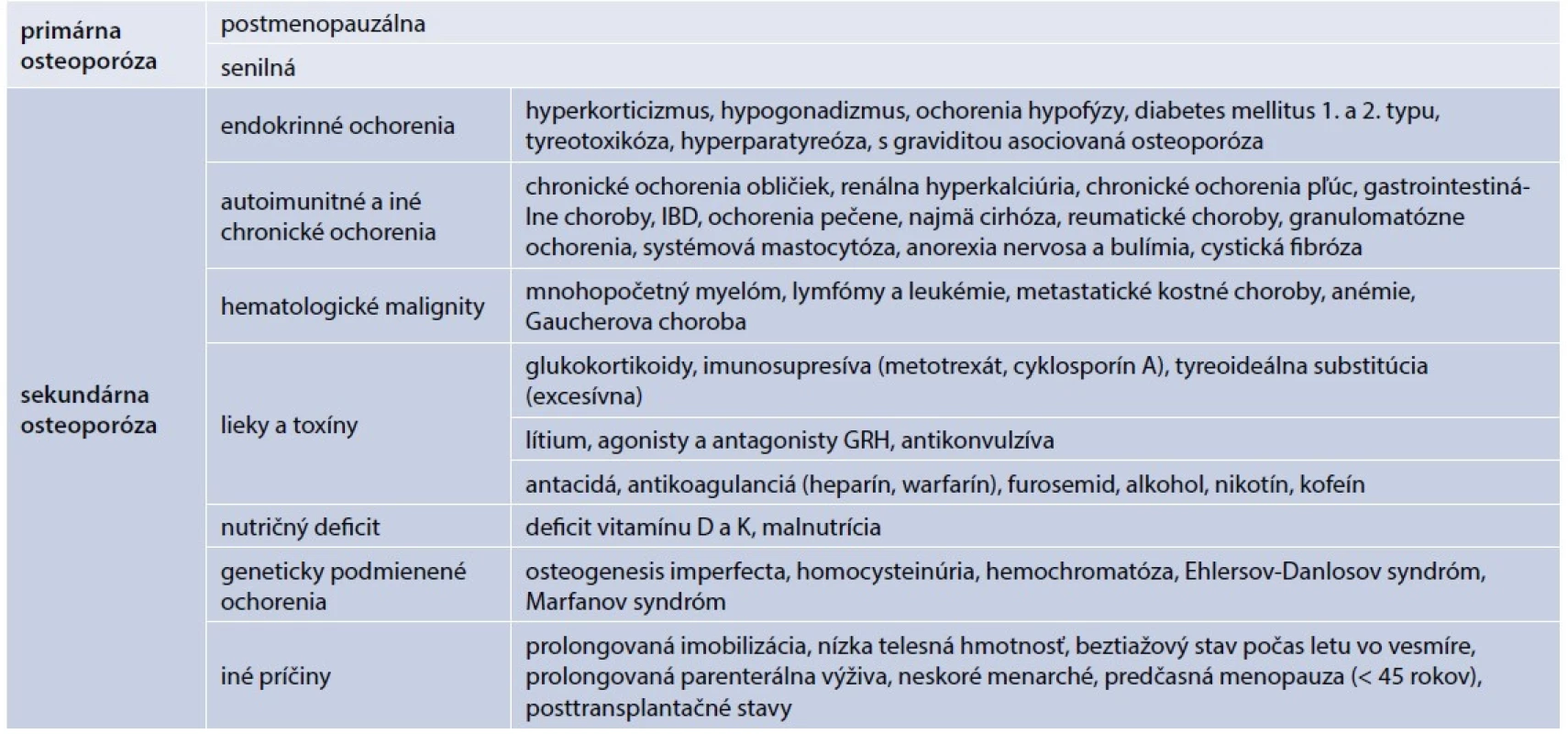
Osteoporózu rozdeľujeme na dva základné typy – primárnu a sekundárnu. Sekundárna osteoporóza je spôsobená známym alebo dosiaľ nezisteným (asymptomatickým) ochorením alebo dlhodobou liečbou, ktorá nepriaznivo ovplyvňuje kostný metabolizmus. U viacerých pacientov je príčina sekundárnej osteoporózy multifaktoriálna. Predovšetkým pri osteoporóze u mužov je potrebné dôkladné prešetrenie príčiny osteoporózy, až 30–64 % osteoporózy u mužov tvorí sekundárna osteoporóza. V rámci endokrinologických ochorení sa najčastejšie stretávame s osteoporózou pri hypogonadizme. U žien pokles estrogénov v menopauze spôsobuje postmenopauzálnu osteoporózu, ktorú spolu so senilnou osteoporózou zaraďujeme do primárnej osteoporózy (tab. 1). Endokrinopatie spôsobujú sekundárnu osteoporózu. Najčastejšími príčinami sú primárna hyperparatyreóza, hyperkorticizmus, tyreotoxikóza, poruchy tvorby rastového hormónu, diabetes mellitus a mužský hypogonadizmus.
Primárna hyperparatyreóza
Primárna hyperparatyreóza (PHP) je najčastejšou príčinou hyperkalciémie. Spôsobuje ju adenóm prištítnych teliesok (85 %), v 14 % ide o hyperpláziu prištítnych teliesok a veľmi zriedkavý je karcinóm (1 %) [1]. Nadprodukcia parathormónu (PTH) vedie k vyplavovaniu vápnika z kostí, čo sa následne prejaví hyperkalciémiou a hyperkalciúriou. Diagnóza PHP je laboratórna, typická je hyperkalciémia s hyperkalciúriou, elevovaný parathormón pri normálnej hladine vitamínu D3 a normálnej renálnej funkcii. Nízka hladina vitamínu D3 a chronická renálna insuficiencia môžu viesť k sekundárnej hyperparatyreóze, ktorú je potrebné odlíšiť. Sekundárna hyperparatyreóza však na rozdiel od PHP nebýva asociovaná s hyperkalciémiou. Väčšina pacientov s PHP je asymptomatických. Pri závažnejšej hyperkalciémii dochádza k manifestácii klinických prejavov – postihnutiu obličiek v zmysle nefrolitiázy a nefrokalcinózy, postihnutiu kĺbov (chondrokalcinóza), k tvorbe peptických vredov, k postihnutiu kardiovaskulárneho systému, najmä artériovej hypertenzii a poruchám srdcového rytmu, stúpa riziko rozvoja akútnej pankreatitídy a v neposlednom rade dochádza k postihnutiu skeletu.
Skeletálny účinok parathormónu vyplýva z jeho rôzneho účinku na kortikálnu a trabekulárnu kosť. Zatiaľ čo účinok PTH na kortikálnu kosť je katabolický, na trabekulárnu kosť pôsobí anabolicky. Z toho vyplýva, že postihnutie skeletu v zmysle zníženej kostnej denzity sa najviac prejaví na distálnom predlaktí, v ktorom je najviac kortikálnej kosti, menej na krčku femuru, kde kosť tvoria obe zložky, a naopak k zvýšeniu kostnej denzity môže dôjsť v oblasti lumbálnej chrbtice. U žien s postmenopauzálnou osteoporózou sú namerané opačné údaje (najnižšia denzita v oblasti lumbálnej chrbtice), a preto postmenopauzálne pacientky s PHP môžu mať lepšiu denzitu lumbálnej chrbtice ako pacientky bez nej. Dnes už veľmi ojedinele môže PHP viesť k fibróznej cystickej osteitíde, hoci to bolo prvé opísané postihnutie kostí asociované s PHP. Patognomicky ide o subperiostálnu resorpciu. Typické sú lokality osteolýzy vytvárajúce „hnedé tumory“ a lokality kostnej expanzie, ktoré môžu byť mylne zamenené za metastatický proces [2].
Podstatou liečby PHP, a teda aj osteoporózy ňou navodenej, je odstránenie príčiny – operačné odstránenie patologického nálezu prištítnych teliesok podľa odporučených indikácií [3]. V prípade, že operačný zákrok nie je indikovaný, možno miernu hyperkalciémiu kontrolovať dostatočnou hydratáciou, prípadne v kombinácii so slučkovými diuretikami (majú kalciurický efekt). Možnosťou sú aj kalcimimetiká (cinakalcet), ktoré pôsobia na kalciové receptory na povrchu prištítneho telieska a regulujú sekréciu PTH a následnú kalciémiu a kalciúriu. Okrem operačnej liečby žiadna z uvedených liečebných modalít nie je kauzálna, a teda príčina nadprodukcie PTH pretrváva a môže naďalej viesť k poškodzovaniu skeletu. Ak PHP u pacienta už spôsobila zníženie kostnej hustoty na úroveň osteoporózy, je potrebná medikamentózna liečba. V liečbe sa používajú najmä bisfosfonáty spomaľujúce kostný obrat a znižujúce kalciémiu a kalciúriu. Liečba osteoporózy u pacientov s PHP alendronátom viedla k zvýšeniu kostnej denzity. Pacient s PHP má mať adekvátnu hladinu vitamínu D, pretože jeho nedostatok môže zvýšiť vyplavovanie PTH z nepostihnutých prištítnych teliesok a podporiť tak rozvoj osteoporózy. Pacienti majú mať kontrolovanú denzitometriu každé 2 roky, resp. častejšie podľa pridružených komorbidít.
Hyperkorticizmus
Incidencia endogénneho Cushingovho syndrómu nie je vysoká (1 až 2 prípady na 500 000 obyvateľov za rok). Oveľa závažnejším problémom z hľadiska osteoporózy je iatrogénne navodený Cushingov syndróm následkom dlhodobej kortikoterapie – osteoporóza indukovaná glukokortikoidmi (GIOP).
GIOP predstavuje v súčasnosti najčastejšiu a najzávažnejšiu formu sekundárnej osteoporózy. Prevalencia liečby perorálnymi glukokortikoidmi predstavuje 0,9 % u dospelej populácie a až 2,5 % u populácie staršej ako 70 rokov [4]. Najčastejšími indikáciami na ich podávanie sú respiračné, muskuloskeletálne a kožné ochorenia. Viac ako 50 % pacientov dlhodobo liečených glukokortikoidmi (> 3 mesiace) zrýchlene stráca kostnú hmotu a úbytok sa objavuje už počas prvých týždňov. Incidencia osteoporotických fraktúr sa udáva u pacientov s endogénnym hyperkorticizmom 20 % a u pacientov dlhodobo liečených glukokortikoidmi až 30–50 %. Zlomeniny sa objavujú 3–6 mesiacov od začatia liečby. Preferenčne býva postihnutá trabekulárna kosť, v ktorej je efekt glukokortikoidov výraznejší [5]. Histomorfometricky bývajú zúžené trabekuly pri zachovaní ich celkového počtu a štruktúry. Tento fakt podporuje i zistenie relatívnej reverzibility kostných zmien pri vysadení liečby [4]. Závažnosť kostnej straty pri liečbe glukokortikoidmi závisí od podávanej dávky a trvania liečby [6,7].
Za rizikovú dávku glukokortikoidov sa považuje dávka ≥ 5 mg prednizónu za deň [8]. Na Slovensku máme definovanú rizikovú dávku prednizónu ≥ 7,5 mg denne počas aspoň 3 mesiacov, resp. kumulatívnu dávku 2,7 g za rok. Z tejto definície zároveň vychádza Odborné usmernenie MZ SR pre diagnostiku a liečbu GIOP (schéma) [9]. O význame glukokortikoidov ako rizikového faktora vzniku osteoporózy hovorí i fakt, že užívanie glukokortikoidov v anamnéze má v rámci 10-ročného rizika vzniku osteoporotickej zlomeniny krčka stehnovej kosti po rodinnej anamnéze najväčší význam [10].
![Schéma. Odborné usmernenie MZ SR pre diagnostiku a liečbu osteoporózy indukovanej glukokortikoidmi.
Upravené podľa [18]](https://pl-master.mdcdn.cz/media/image_pdf/95b622004c99dd4c597db870ede3e4bb.jpeg?version=1628588238)
Mechanizmus účinku glukokortikoidov na kostné tkanivo je pomerne zložitý a zahŕňa priamy efekt na kostnú remodeláciu, absorpciu kalcia, kostné svalstvo a systém pohlavných hormónov. Diagnostika osteoporózy indukovanej glukokortikoidmi pozostáva z dôkladnej anamnézy, klinického vyšetrenia, posúdenia kostnej denzity a kostného obratu. Dôležitou súčasťou vyšetrenia je pátranie po asymptomatických vertebrálnych fraktúrach (RTG, morfometrické denzitometrické vyšetrenie). Patognomický je pokles markera osteoformácie osteokalcínu pri vzostupe osteoresorpčných markerov.
Základom prevencie a liečby osteoporózy indukovanej glukokortikoidmi je minimalizácia dávky a dĺžky podávania glukokortikoidov. Automatickou súčasťou prevencie i liečby je odstránenie ostatných rizikových faktorov (fajčenie, alkohol, nízka pohybová aktivita, atď). V prípade endogénne podmieneného hyperkorticizmu je esenciálne odstránenie primárnej príčiny. Základným pilierom všetkých preventívnych i terapeutických režimov je podávanie kalcia v dávke 1 000–1 200 mg denne a vitamínu D3 v dávke aspoň 800 IU denne [9]. Najčastejšou terapeutickou skupinou v liečbe GIOP sú bisfosfonáty. Schopnosť redukovať vznik osteoporotických zlomenín bola preskúmaná v rôznych rizikových skupinách a pri rôznych liečebných glukokortikoidných režimoch v prospektívnych randomizovaných, placebom kontrolovaných štúdiách pre alendronát, risedronát a etidronát. Najlepšie dokumentovaný efekt má z bisfosfonátov kyselina zoledrónová. Ďalšou vhodnou liečbou GIOP je teriparatid [11], pretože priamo stimuluje osteoblastogenézu a inhibuje apoptózu osteoblastov [12], to znamená, že zasahuje do oboch mechanizmov, ktorými glukokortikoidy podmieňujú pokles kostnej hustoty. Pacienti, ktorí užívali teriparatid, mali vyššiu kostnú denzitu v oblasti lumbálnej chrbtice a proximálneho femuru v porovnaní s pacientmi, ktorí boli liečení alendronátom. V prípade nevertebrálnych fraktúr signifikantný rozdiel nebol pozorovaný [13].
Ochorenia štítnej žľazy
Z ochorení štítnej žľazy má vplyv na kostný metabolizmus najmä neliečená hypertyreóza a supresná liečba tyroxínom u pacientok s karcinómom štítnej žľazy. Primerane substituovaná hypotyreóza k osteoporóze nevedie.
Hlavnými príčinami hypertyreózy sú Gravesova-Basedowova choroba, toxická viacuzlová struma a toxická jednouzlová struma (toxický adenóm). U pacientov dochádza k zvýšeniu kostného obratu, laboratórne býva zvýšená kalciémia a kalciúria, supresia PTH, nižšie hladiny vitamínu D3, zvyšuje sa hladina markerov kostného obratu. U niektorých pacientov možno zaznamenať zvýšenú kostnú prestavbu, ktorá však nemusí mať vplyv na výsledok kostnej denzity. U starších pacientok dochádza k zníženiu hustoty kostného minerálu (Bone Mineral Density – BMD) a stúpa riziko vzniku fraktúr. U postmenopauzálnych žien s tyreotoxikózou v anamnéze pretrváva riziko vzniku osteoporózy ešte dlhý čas po upokojení toxikózy. Prospektívne štúdie poukazujú na zvýšenie rizika fraktúr proximálneho femuru u pacientov s aktuálnou hypertyreózou (RR 2,5), rovnako aj u pacientov s hypertyreózou v anamnéze (RR 1,8). Iné retrospektívne štúdie zistili signifikantne vysoké riziko fraktúr (RR 1,26–2,29) u pacientov s hypertyreózou v čase stanovenia diagnózy a pokles tohto rizika po liečbe (RR 0,66). BMD sa odporúča merať predovšetkým u postmenopauzálnych žien s anamnézou hypertyreózy.
Exogénne podávanie supresívnych dávok L-tyroxínu na potlačenie TSH sa používa s cieľom zamedziť progresii alebo rekurencii karcinómu štítnej žľazy. Rizikové sú najmä pacientky v menopauze užívajúce supresné dávky L-tyroxínu. Indikáciu supresívnej terapie je vždy dôležité posudzovať s prihliadnutím na riziko osteoporózy. Podľa štandardných smerníc prevencie osteoporózy má byť BMD vyšetrená 1 až 2 roky od začiatku supresívnej liečby, s následnými kontrolami v 1 - až 2-ročných intervaloch. U žien po menopauze so súčasnou tyreosupresnou liečbou sú potrebné preventívne opatrenia (kalcium, vitamín D, pohyb) [9,14].
Poruchy tvorby rastového hormónu
Účinok rastového hormónu (Growth Hormone – GH) na skelet je komplexný a nie je podmienený len GH a IGF, ale aj samotnými proteínmi viažucimi IGF v plazme, ktoré môžu mať buď inhibičný, alebo stimulujúci vplyv na pôsobenie IGF.
Dospelí pacienti s deficitom rastového hormónu (Growth Hormone Deficiency – GHD) majú znížený kostný obrat a kosť je mierne rezistentná na účinok parathormónu. Typický je obraz nízkoobratovej osteoporózy predilekčne v oblasti kortikálnej kosti. Účinok na kostnú denzitu sa potenciuje, ak je súčasne pri deficite rastového hormónu prítomný deficit iných hormónov hypofýzy – najmä gonadotropínov.
Liečba rastovým hormónom u pacientov s GHD viedla k zvýšeniu BMD, avšak až po dlhšom čase užívania (18–24 mesiacov). V úvode liečby (6–12 mesiacov) bol dokonca zaznamenaný pokles BMD. Predpokladá sa, že počiatočná redukcia rezultuje zo zvýšenia remodelačného priestoru počas zvýraznenej aktivácie kostného obratu pri terapii GH. Neskorší vzostup BMD sa vysvetľuje ukončením remodelačných cyklov iniciovaných na začiatku terapie. Efekt liečby GH bol zaznamenaný najmä u mužov, u žien boli zmeny nevýznamné. Predpokladá sa, že príčinou tejto diskrepancie môže byť užívanie perorálnych estrogénov pri súčasnom hypogonadizme, ktoré následne narušujú signalizáciu GH-IGF1 [15].
Akromegália je ochorenie charakterizované nadprodukciou rastového hormónu, za ktorú je v 99 % prípadov zodpovedný nezhubný adenóm hypofýzy. Pre nadbytok rastového hormónu je typický vysoký kostný obrat s prevahou osteoresorpcie. Laboratórne sú vyššie sérové hladiny kalcia, fosforu, vitamínu D a PTH. Údaje o vzniku osteoporózy u pacientov s akromegáliou sú kontroverzné. Podľa viacerých klinických štúdií je prítomný pokles BMD v oblasti lumbálnej chrbtice, v ktorej je najväčšie zastúpenie trabekulárnej kosti. V oblasti chrbtice bývajú prítomné deformity a predpokladá sa aj vyššie riziko fraktúr. Naopak, v oblasti distálneho predlaktia, v ktorom je prevaha kortikálnej kosti, bol pozorovaný nárast kostnej denzity. Viacerí autori považujú za príčinu zníženej kostnej hustoty u pacientov s akromegáliou najmä centrálny hypogonadizmus, ktorý je častý pri adenóme hypofýzy.
Diabetes mellitus
U diabetikov možno nájsť rôzne typy metabolického postihnutia kostí, okrem osteoporózy aj osteomaláciu, osteopetrózu i osteodystrofiu. Diabetici 1. aj 2. typu (DM1T, DM2T) majú vyššie riziko bedrových aj vertebrálnych fraktúr [16,17]. Najväčšie riziko majú ženy s DM1T. Hlavným poškodzujúcim mechanizmom je pokles kostnej formácie a znížený kostný obrat. Znížená koncentrácia inzulínu je tiež považovaná za nezávislý prediktor rizika fraktúr. Avšak DM2T, pri ktorom je kostná hmota naopak zvýšená, je paradoxne tiež asociovaný so zvýšením rizika fraktúr. Aj keď kostná denzita pri DM2T zostáva zachovaná, „nechráni“ pred osteoporotickými fraktúrami, pretože je zmenená kvalita kosti. Mnohé štúdie hovoria o zmenách v markeroch kostného obratu, ako aj v humorálnom pôsobení faktorov a látok produkovaných tukovým tkanivom. K osteoporóze u diabetikov prispieva okrem zlej glykemickej kompenzácie liečba glitazónmi, diabetická nefropatia a nedostatok vitamínu D. Pri zvýšenom výskyte fraktúr zohráva úlohu aj zvýšené riziko pádov asociované s hypoglykémiou a diabetickou neuropatiou (porucha rovnováhy a reflexov).
V rámci preventívnych opatrení je najdôležitejšia korekcia glykemickej kompenzácie, odstránenie ďalších rizikových faktorov (fajčenie, alkohol), preventívne podávanie vápnika a vitamínu D.
Mužský hypogonadizmus
Rovnako ako u žien, aj u mužov hypogonadizmus vedie k osteoporóze. Príčina hypogonadizmu môže byť primárna (porucha na úrovni semenníkov) alebo sekundárna (porucha na úrovni hypotalamu – hypofýzy).
Vplyv testosterónu na kosť môže byť dvojaký –priamo pôsobením molekuly testosterónu, resp. jej aktívneho metabolitu dihydrotestosterónu prostredníctvom androgénových receptorov, alebo konverziou testosterónu na estradiol pomocou enzýmu aromatázy a následným účinkom estradiolu v cieľových tkanivách (kostiach) pomocou estrogénových receptorov [2]. Testosterón v in vitro štúdiách zvyšoval proliferáciu a znižoval apoptózu osteoblastov, podobne ako estrogény zabraňuje kostnej resorpcii indukovanej parathormónom a tyroxínom a tvorbe osteoresorpčných stimulátorov IL1, IL6. Nie je jednoznačný konsenzus, či na zachovanie kostnej denzity u mužov je dôležitejší samotný testosterón, alebo estradiol, a nie je ani jasné, či ich účinok na kosť je synergický, alebo nezávislý. Isté je, že obidva sú dôležité na zachovanie optimálneho BMD u mužov.
Podávanie testosterónu hypogonadickým mužom signifikantne zvyšuje ich BMD. Po 6 mesiacoch liečby testosterónom bola zaznamenaná supresia markerov osteoresorpcie [9]. Dôležitosť vplyvu testosterónu na kostnú hmotu mužov môžeme vidieť aj u pacientov s karcinómom prostaty, ktorí užívajú antiandrogénovú liečbu. Pozitívny účinok testosterónu na kosť je potenciovaný aj jeho pozitívnym vplyvom na svalovú hmotu, celkovú silu, a tým aj znížené riziko pádov.
Záver
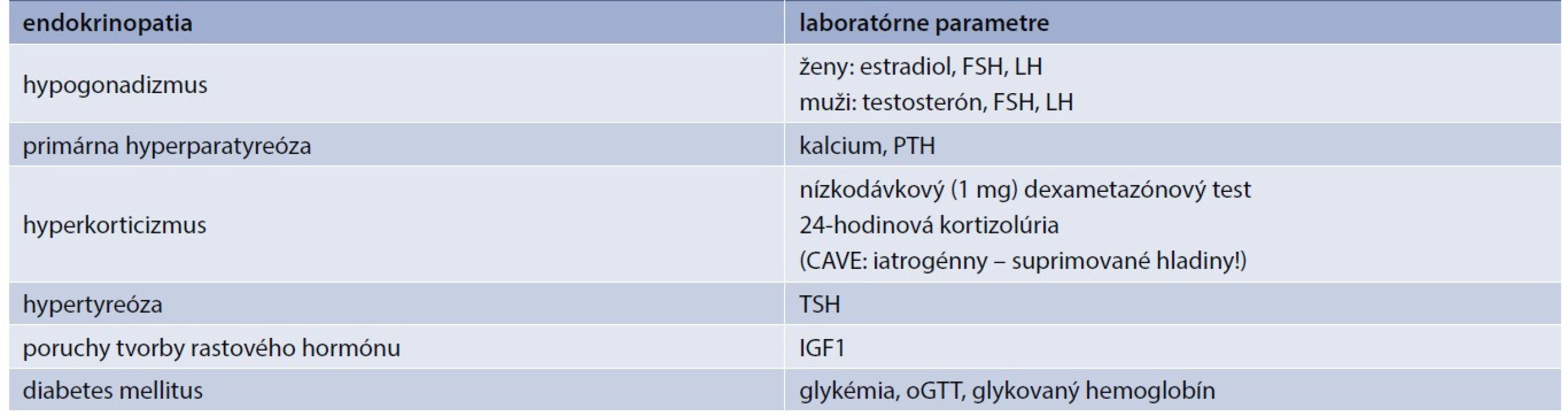
V rámci diferenciálnej diagnostiky osteoporózy treba myslieť aj na sekundárnu osteoporózu spôsobenú endokrinopatiami, a to najmä u mladších pacientov a pacientov mužského pohlavia. Dôkladné odobratie anamnézy môže už v úvode viesť k identifikácii príčiny (napr. užívanie kortikoidov pri GIOP alebo anamnéza tumoru hypofýzy či neliečenej tyreotoxikózy) [18]. V rámci laboratórnych vyšetrení by sme u pacienta mali urobiť skríning na vylúčenie primárnej hyperparatyreózy (Ca, PTH), tyreotoxikózy (TSH), Cushingovho syndrómu (sérový kortizol, dexametazónový test, ev. 24-hodinový moč na kortizolúriu), glykémie, IGF1 a vyšetrenie testosterónu u mužov (tab. 2). Vyšetrenie pohlavných hormónov – estradiol, FSH a LH – je samozrejmosťou u premenopauzálnych pacientok s osteoporózou. Môže odhaliť či už primárny hypogonadizmus následkom predčasného ovariálneho zlyhania, alebo sekundárny hypogonadizmus pri hypotalamo-hypofýzových poruchách.
Liečebne sa zameriavame na odstránenie vyvolávajúcej príčiny, ak je to možné. V prípade, že kauzálna liečba možná nie je, hlavnú úlohu zohráva suplementácia vápnika a vitamínu D, odstránenie rizikových faktorov, prípadne špecifická liečba podľa príslušných odporúčaní.
Autori prehlasujú, že nemajú konflikt záujmov.
prof. MUDr. Juraj Payer, PhD., MPH, FRCP | payer@ru.unb.sk | www.unb.sk
Doručené do redakcie 13. 4. 2021
Prijaté po recenzii 28. 4. 2021
Zdroje
- Wass JAH, Turner H. Oxford Handbook od Endocrinology and Diabetes. Oxford Univesity Press: Oxford 2006 : 548–552. ISBN: 0–19–263052–0.
- Gardner D, Shoback D. Greenspan‘s Basic and Clinical Endocrinology. 9th ed. McGraw-Hill Medical: China 2011 : 244–250. ISBN 978–0071622431.
- Bilezikian J, Khan AA, Potts JT Jr. Guidelines for the Management of Asymptomatic Primary Hyperparathyroidism: Summary Statment from the 3rd International Workshop. J Clin Endocrinol Metab 2009; 94(2): 335–339. Dostupné z DOI: <http://dx.doi.org/10.1210/jc.2008–1763>.
- Van Staa TP, Leufkens HG, Cooper C. The epidemiology of corticosteroid-induced osteoporosis: a meta-analysis. Osteoporos Int 2002; 13(10): 777–787. Dostupné z DOI: <http://dx.doi.org/10.1007/s001980200108>.
- Zikán V. Glukokortikoidy a osteoporóza. Vnitř Lék 2007; 53(7–8): 831–840.
- Van Staa TP, Leufkens HGM, Abenhaim L et al. Oral corticosteroids and fracture risk: relationship to daily and cumulative doses. Rheumatology (Oxford) 2000; 39(12): 1383–1389. Dostupné z DOI: <http://dx.doi.org/10.1093/rheumatology/39.12.1383>.
- Van Staa T, Leufkens HGM, Abenhaim L et al. Use of oral corticosteroids and risk of fractures. J Bone MinerRes 2000; 15(6): 993–1000. Dostupné z DOI: <http://dx.doi.org/10.1359/jbmr.2000.15.6.993>.
- Van Staa TP. The pathogenesis, epidemiology and management of glucocorticoid-induced osteoporosis. Calcif Tissue Int 2006; 79(3) :129–137. Dostupné z DOI: <http://dx.doi.org/10.1007/s00223–006–0019–1>.
- Payer J, Killinger Z a kol. Osteoporóza.: Herba: Bratislava 2012. ISBN 978–80–8971–94–1.
- Kanis JA, Johnell O, Oden A et al. FRAX and theassessment of fracture probability in men and women from the UK. Osteoporos Int 2008;19(4):385–397. Dostupné z DOI: <http://dx.doi.org/10.1007/s00198–007–0543–5>.
- Saag KG, Shane E, Boonen S et al. Teriparatide or alendronate in glucocorticoid-induced osteoporosis. N Engl J Med 2007; 357(20): 2028–2039. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJMoa071408>.
- Štěpán J. Glukokortikoidy indukovaná osteoporóza: Nové možnosti prevence a léčby. Interní Med 2008; 10(7–8): 323–326.
- Čierny D, Killinger Z, Payer J. Postavenie teriparatidu a intaktného parathormónu v liečbe osteoporózy. Slov Lek 2007; 17(9–10): 226–230.
- Baqi L, Payer J. Tyreoidálne hormóny a kosť. Ost Bull 2003; 2 : 33–42.
- Kužma M, Payer J. Deficit rastového hormónu a jeho vplyv na kostnú minerálnu denzitu a riziko osteoporotických fraktúr. Cas Lek Cesk 2010; 149(5): 211–216.
- Janghorbani M, Van Dam RM, Willett WC et al. Systematic review of type 1 and type 2 diabetes mellitus and risk of fracture. Am J Epidemiol 2007; 166(5): 495–505. Dostupné z DOI: <http://dx.doi.org/10.1093/aje/kwm106>.
- Vestergaard P, Rejnmark L, Mosekilde L. Relative fracture risk in patients with diabetes mellitus, and the impact of insulin and oral antidiabetic medication on relative fracture risk. Diabetologia 2005; 48(7): 1292–1299. Dostupné z DOI: <http://dx.doi.org/10.1007/s00125–005–1786–3>.
- Vestník MZ SR 2009, čiastka 52, s. 379–381.
Štítky
Diabetologie Endokrinologie Interní lékařstvíČlánek vyšel v časopise
Forum Diabetologicum

-
Všechny články tohoto čísla
- Hodnotenie rizika osteoporózy u pacienta s diabetes mellitus 2. typu – keď meranie kostnej hustoty nepostačuje
- Manažment osteoporózy u diabetika
- Prínos liečby metformínom v liekových formách s predľženým uvoľňovaním
- Deintenzifikácia liečby pacienta s diabetes mellitus 2. typu môže mať benefitný účinok
- Populačné rozdiely v prevalencii diabetes mellitus, jeho rizikových faktorov a komplikácií
- Osteoporóza pri endokrinopatiách
- Bazálne analógy inzulínu 2. generácie v klinických štúdiách s využitím kontinuálneho monitorovania koncentrácie glukózy
- Skúsenosti z praxe potvrdzujú výsledky štúdií RCT a RWE s empagliflozínom: kazuistiky
- Liečba diabetického edému makuly intravitreálnym dexametazónom: kazuistika
- Forum Diabetologicum
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle
- Osteoporóza pri endokrinopatiách
- Bazálne analógy inzulínu 2. generácie v klinických štúdiách s využitím kontinuálneho monitorovania koncentrácie glukózy
- Deintenzifikácia liečby pacienta s diabetes mellitus 2. typu môže mať benefitný účinok
- Populačné rozdiely v prevalencii diabetes mellitus, jeho rizikových faktorov a komplikácií
