Účinnosť a znášanlivosť vildagliptínu ako lieku druhej voľby v porovnaní s inými perorálnymi antidiabetikami pri diabetes mellitus 2. typu
Celosvetová observačná štúdia v podmienkach reálnej klinickej praxe (EDGE – výsledky subanalýzy pacientov zaradených na Slovensku)
The efficiency and tolerability of vildagliptin as the second-line drug as compared with other oral antidiabetics for diabetes mellitus type 2:
Worldwide Observation Study in the conditions of clinical practice (EDGE – results of the subanalysis of included patients in Slovakia)
Introduction:
The care of patients with type 2 diabetes mellitus (DM2T) is made more complicated by an increasing number of drugs now available for the treatment of this illness. While metformin is an established first-line drug within the monotherapy for DM2T, later on it is usually needed to intensify the treatment through a combination of multiple antidiabetics. The most recent guidelines for the treatment of diabetes recommend, when the second-line oral antidiabetics are being chosen, that not only their efficiency but also tolerability, price and patients’ preferences should be considered. There is only few literary data available from the large drug studies within the actual clinical practice that would make it possible to complete and compare the data on efficiency and safety of the new drugs, obtained from the randomized controlled clinical trials.
Target of the study:
The study aimed to evaluate the efficiency and tolerability of vildagliptin as compared with other oral antidiabetics (PAD) as an add-on to PAD monotherapy in the conditions of clinical practice and review the benefits and limitations of the extensive “pragmatic“ studies. In this paper we present the results of the subanalysis in the patients included in the EDGE study in the Slovak Republic.
Materials and methods:
EDGE was a prospective one-year observation study conducted in various countries of the world, which in the conditions of clinical practice focused on the efficiency and tolerability of vildagliptin (dipeptidyl peptidase 4 inhibitor), added on to the monotherapy with an (per)oral antidiabetic drugs (PAD), as compared with any combinations of two PADs without vildagliptin (the combined group). In our subanalysis, 45 physicians engaged in the trial in Slovakia provided data on the effects of PAD added on to metformin in 1 121 patients with DM2T, who did not reach a satisfactory glycaemic compensation through a PAD monotherapy. The primary target indicator of efficiency and safety (PEP) was defined as the proportion of patients who reached a decrease in HbA1c > 0.3%, without hypoglycaemia, weight gain, peripheral oedema or gastrointestinal undesirable effects. The clinically most significant secondary target indicator (SEP) evaluated the proportion of patients with the initial HbA1c ≥7%, who reached a target HbA1c < 7% without hypoglycaemia, or ≥ 3% weight gain.
Results:
In accordance with the general data from the study, the treatment of DM2T within EDGE was intensified using the other PAD at an average HbA1c 8 % (± 1,33), with no difference identified between the cohorts in Slovakia as regards the initial value HbA1c. After adding of the second drug, more than half of the patients successfully reached the primary target indicator (57.1 % of the patients treated with vildagliptin and 60.04 % patients treated with a comparator), which means OR 0.89 (95% CI: 0.70 -1.13; p = 0.32) without any significant difference between the cohorts. The trend in favour of the vildagliptin based treatment was observed in relation to the secondary target indicator (SEP) being reached in patients with the initial HbA1c ≥7%, (38.5% of the patients treated with vildagliptin as compared to 33 % of those treated by the comparator), OR 1,27 (95% CI: 0,97-1,66; p = 0,082), although without attaining statistical significance. The occurrence of undesirable effects was generally low and the safety profile of vildagliptin and the other PADs matched the previous data obtained in the studies.
Conclusion:
The EDGE study has proved that vildagliptin as the second-line PAD can, in the conditions of clinical practice, effectively reduce HbA1c to a ≤ 7% target value with a satisfactory safety profile, which was also confirmed in the Slovak cohort of the study.
Key words:
diabetes mellitus 2. type – metformin – oral antidiabetic drugs – vildagliptin
Autoři:
Katarína Rašlová 1; Dagmar Bucková 2
Působiště autorů:
Metabolické centrum MUDr. Kataríny Rašlovej, s. r. o., Bratislava
1; Novartis Slovakia s. r. o., Bratislava
2
Vyšlo v časopise:
Forum Diab 2014; 3(3): 155-162
Kategorie:
Novinky z farmakoterapie
Souhrn
Úvod:
Starostlivosť o pacientov s diabetes mellitus 2. typu (DM2T) je komplikovaná zvyšujúcim sa počtom liekov, ktoré sú v súčasnosti pre liečbu tohto ochorenia k dispozícii. Zatiaľ čo metformín je uznávaným liekom prvej voľby v rámci monoterapie pri DM2T, v neskoršom období je zvyčajne potrebná intenzifikácia liečby kombináciou viacerých antidiabetík. Najnovšie smernice pre liečbu DM2T odporúčajú pri výbere druhej línie perorálnych antidiabetík zvažovať nielen ich účinnosť, ale aj znášanlivosť, cenu a preferencie pacientov. K dispozícii je len málo literárnych údajov z veľkých liekových štúdií v podmienkach reálnej klinickej praxe, ktoré by umožnili doplniť a porovnať údaje o účinnosti a bezpečnosti nových liekov, ktoré sa získali z randomizovaných kontrolovaných klinických skúšaní.
Cieľ štúdie:
Táto štúdia mala za cieľ zhodnotiť účinnosť a znášanlivosť vildagliptínu v porovnaní s inými perorálnymi antidiabetikami (PAD) ako prídavnej liečby k monoterapii PAD v podmienkach reálnej klinickej praxe a preskúmať výhody a obmedzenia veľkých „pragmatických“ štúdií. V tomto článku uvádzame výsledky subanalýzy u pacientov zaradených do štúdie EDGE v Slovenskej republike.
Materiál a metódy:
EDGE bola prospektívna, jednoročná, observačná štúdia prebiehajúca vo viacerých krajinách sveta, ktorá v podmienkach reálnej klinickej praxe sledovala účinnosť a znášanlivosť vildagliptínu (inhibítora dipeptidylpeptidázy 4), pridaného k monoterapii perorálnym antidiabetikom (PAD), v porovnaní s akoukoľvek kombináciou dvoch PAD bez vildagliptínu (zlúčená skupina). V našej subanalýze poskytlo 45 skúšajúcich lekárov zo Slovenska údaje o účinkoch PAD pridaných k metformínu u 1 121 pacientov s DM2T, ktorí nedosiahli uspokojivú glykemickú kompenzáciu monoterapiou PAD. Primárny cieľový ukazovateľ účinnosti a bezpečnosti (PEP) bol definovaný ako podiel pacientov, ktorí dosiahli pokles HbA1c > 0,3 %, bez hypoglykémie, nárastu telesnej hmotnosti, periférneho edému alebo gastrointestinálnych nežiaducich udalostí. Klinicky najvýznamnejší sekundárny cieľový ukazovateľ (SEP) hodnotil podiel pacientov s východiskovým HbA1c ≥ 7 %, ktorí dosiahli cieľový HbA1c < 7 % bez hypoglykémie alebo ≥ 3 % nárastu telesnej hmotnosti.
Výsledky:
V súlade s celkovými dátami zo štúdie, intenzifikácia liečby DM2T v štúdii EDGE pomocou druhého PAD sa uskutočnila pri priemernom HbA1c 8 % (± 1,33), pričom medzi kohortami na Slovensku nebol žiadny rozdiel vo východiskovej hodnote HbA1c. Po pridaní druhého lieku viac ako polovica pacientov úspešne dosiahla primárny cieľový ukazovateľ (57,1 % pacientov liečených vildagliptínom a 60,04 % pacientov liečených komparátorom), čo znamená OR 0,89 (95% CI: 0,70 -1,13; p = 0,32) bez signifikantného rozdielu medzi skupinami. Trend v prospech liečby založenej na vildagliptíne sa pozoroval pri dosahovaní sekundárneho cieľového ukazovateľa (SEP) u pacientov s východiskovým HbA1c ≥ 7 %, (38,5 % pacientov liečených vildagliptínom v porovnaní s 33 % pacientov liečených komparátorom), OR 1,27 (95% CI: 0,97-1,66; p = 0,082), avšak bez dosiahnutia štatistickej významnosti. Výskyt nežiaducich udalostí bol vo všeobecnosti nízky a profil bezpečnosti vildagliptínu a ostatných PAD bol v súlade s predchádzajúcimi údajmi zo štúdií.
Záver:
Štúdia EDGE preukázala, že v podmienkach reálnej klinickej praxe môže vildagliptín ako PAD druhej línie efektívne znižovať HbA1c na cieľovú hodnotu ≤ 7 % s dobrým profilom bezpečnosti, čo sa potvrdilo aj v slovenskej kohorte štúdie.
Kľúčové slová:
diabetes mellitus 2. typu – metformín – perorálne antidiabetiká – vildagliptín
Úvod
Diabetes mellitus 2. typu (DM2T) je progresívne ochorenie. Na udržanie dobrej glykemickej kompenzácie a zabránenie rozvoja neskorých komplikácií je často potrebná kombinovaná liečba. Starostlivosť o diabetikov 2. typu je komplikovaná zvyšujúcim sa počtom liekov, ktoré sú k dispozícii, obavami z možných nežiaducich účinkov týchto liekov a neistotou týkajúcou sa mikrovaskulárnych a makrovaskulárnych dôsledkov intenzívnej glykemickej kompenzácie. Zatiaľ čo metformín je uznávaným liekom prvej voľby v rámci monoterapie pri DM2T, v neskoršom období je zvyčajne potrebná intenzifikovaná liečba vo forme kombinácie viacerých liekov, pričom dôraz sa kladie na starostlivý výber lieku, aby sa zabránilo nechceným nežiaducim účinkom. Štúdia United Kingdom Prospective Diabetes Study (UKPDS) preukázala, že u väčšiny pacientov bolo do 3 rokov od zaradenia do štúdie potrebné pridanie druhého perorálneho antidiabetika (PAD), aby sa udržala glykemická kompenzácia [1]. Za zmienku stojí, že v Európe dosiahne cieľovú hodnotu HbA1c iba približne 30 % pacientov s DM2T [2].
Najnovšie smernice pre liečbu DM2T odporúčajú pri výbere optimálnej eskalačnej liečby antidiabetikami pridanými k metformínu zvažovať ich účinnosť, znášanlivosť, cenu a preferencie pacientov [3].
Vzhľadom na prísne kritériá pre vykonávanie randomizovaných kontrolovaných klinických skúšaní, tieto skúšania poskytujú len limitované informácie o účinnosti lieku v podmienkach reálnej klinickej praxe. Na druhej strane observačné štúdie, vďaka napr. menej prísnym kritériám pre zaradenie/vylúčenie pacientov a iným charakteristikám, umožňujú lepšie zovšeobecnenie výsledkov v prostredí reálnej klinickej praxe [4,5,6].
EDGE bola prospektívna, jednoročná, observačná štúdia v podmienkach reálnej klinickej praxe. Realizovala sa celosvetovo a bola zameraná na účinnosť a znášanlivosť vildagliptínu – inhibítora dipeptylpeptidázy 4 (DPP4), ktorý sa pridával k monoterapii perorálnym antidiabetikom (PAD), v porovnaní s akoukoľvek dvojkombináciou PAD bez vildagliptínu (zlúčená skupina).
Vildagliptín patrí do relatívne novej skupiny PAD – inhibítorov DPP4, ktorých mechanizmus účinku je založený na inkretínovom efekte. Vildagliptín zvyšuje endogénne hladiny GLP1 (peptid 1 podobný glukagónu) a GIP (glukózodependentný inzulínotropný polypeptid) tým, že selektívne a reverzibilne inhibuje enzým dipeptylpeptidázu 4 (DPP4), ktorý štiepi a tým deaktivuje GLP1 a GIP [7]. Viaceré klinické skúšania preukázali klinicky významné zníženie hodnoty HbA1c pri liečbe vildagliptínom 50 mg a 100 mg denne bez nárastu telesnej hmotnosti a s minimálnou hypoglykémiou pri monoterapii ako aj v kombinácii s najbežnejšie používanými skupinami perorálnych antidiabetík [8].
Štúdia EDGE, ktorá predstavuje veľkú štúdiu v reálnej klinickej praxi, mala za cieľ zhodnotiť účinnosť a znášanlivosť vildagliptínu v dvojkombinácii s iným PAD voči všetkým ostatným dvojkombináciám PAD, ale takisto aj poukázať na výhody a limitácie veľkých štúdií v reálnej klinickej praxi. Táto štúdia sa takisto zamerala na zhodnotenie bezpečnostného profilu duálnej liečby založenej na vildagliptíne, vrátane fixnej kombinácie vildagliptín/metformín v porovnaní s komparačnou duálnou liečbou perorálnymi antidiabetikami v podmienkach reálnej klinickej praxe [9].
Ďalej uvádzame výsledky subanalýzy pacientov zaradených na Slovensku.
Metódy
Dizajn štúdie
EDGE (Effectiveness of Diabetes control with vildaGliptin and vildagliptin/mEtformin) bola jednoročná, prospektívna, observačná, kohortová štúdia, v ktorej sa sledovalo 45 868 pacientov z 2 957 centier v 27 krajinách v Európe, Strednej a Južnej Amerike, Ázii a na Strednom Východe [9]. Z tohto počtu bolo 1 121 pacientov zaradených v 45 centrách na Slovensku. Zaradení boli dospelí pacienti (vo veku > 18 rokov) s DM2T a s nedostatočnou glykemickou kompenzáciou dosiahnutou pri užívaní sulfonylurey (SU), metformínu, tiazolidíndiónu (TZD), glinidu alebo inhibítora alfa-glukozidázy (AGI) v monoterapii a u ktorých sa zvažovalo pridanie druhého PAD. Vylúčení boli pacienti, u ktorých sa plánovala intenzifikácia liečby iným inhibítorom DPP4 ako vildagliptínom, alebo inkretínovým mimetikom/analógom alebo pacienti, ktorí užívali tri alebo viac PAD pri vstupe do štúdie, ako aj tí, u ktorých došlo k zmene PAD alebo skupiny PAD na inú skupinu v čase zaradenia do štúdie, teda pred intenzifikáciou liečby. Vylúčení boli aj pacienti, ktorí v čase vstupu do štúdie užívali inzulín a pacienti s anamnézou precitlivenosti na ktorýkoľvek zo skúšaných liekov alebo liekov s podobnou chemickou štruktúrou.
Ďalšie podrobnosti o dizajne štúdie, vyšetreniach a získavaní údajov sú uvedené v práci Mathieua et al z roku 2013 [9].
Cieľové ukazovatele účinnosti a znášanlivosti
Primárny cieľový ukazovateľ (PEP) bol zadefinovaný ako podiel pacientov, ktorí dosiahli odpoveď na liečbu (pokles HbA1c od začiatku štúdie do 12. mesiaca > 0,3%) bez problémov so znášanlivosťou (periférny edém, dokázaná hypoglykemická príhoda, ukončenie liečby v dôsledku gastrointestinálnych ťažkostí alebo nárast telesnej hmotnosti ≥ 5%).
Jeden z hodnotených sekundárnych cieľových ukazovateľov (SEP) bol zadefinovaný ako podiel pacientov s východiskovou hodnotou HbA1c ≥ 7%, ktorí dosiahli po 12 mesiacoch liečby pokles HbA1c < 7 % bez potvrdenej hypoglykémie a nárastu telesnej hmotnosti (≥ 3 %).
Pacienti, u ktorých sa nedala kategorizovať odpoveď na liečbu z dôvodu chýbajúcich údajov (napr. HbA1c alebo telesnej hmotnosti po 12 mesiacoch liečby) neboli do konečného hodnotenia zaradení. Hlavná analýza primárneho cieľa (PEP) využívala iba populáciu pacientov, ktorí dodržali protokol počas celého trvania štúdie (PP).
Hypoglykémia bola definovaná ako typické symptómy hypoglykémie, ktoré rýchlo ustúpili po podaní perorálnych sacharidov (vrátane miernych aj závažných príhod).
Analýza primárnych a sekundárnych cieľových ukazovateľov účinnosti a znášanlivosti
Táto post-hoc analýza sa zameriavala najmä na deskriptívnu štatistiku. Analýza sa týkala dosahovania primárneho a sekundárneho cieľového ukazovateľa účinnosti a znášanlivosti. Pre tieto ukazovatele sa pravdepodobnosť úspechu analyzovala pomocou binárneho modelu logistickej regresie s výpočtom pomeru šancí (OR) s 95% intervalom spoľahlivosti (CI). OR udáva pomer pravdepodobnosti úspešnej liečby v prospech vildagliptínu alebo vildagliptínu/metformínu voči porovnávaným PAD. V tejto post-hoc analýze sa uvádza iba neadjustované OR. Pokles HbA1c bol adaptovaný k východiskovej hodnote HbA1c pomocou modelu ANCOVA.
Výsledky
Populácia pacientov a východiskové charakteristiky
Na Slovensku bolo do štúdie zaradených 1 121 pacientov, ktorí súhlasili so zaradením podpísaním informovaného súhlasu pacienta. V dôsledku nedostatočnej zdrojovej dokumentácie alebo problémov s kvalitou/presnosťou zadávania údajov bol vylúčený iba jeden pacient (0,09 %) zo všetkých zaradených slovenských pacientov (tab. 1). Pre analýzu východiskových demografických charakteristík a analýzu bezpečnosti bola použitá populácia pacientov podľa liečebného zámeru (ITT – intent-to-treat), ktorá zahŕňala 627 (56 %) pacientov užívajúcich duálnu liečbu s novo predpísaným vildagliptínom a 493 (44 %) pacientov užívajúcich duálnu liečbu s iným PAD ako vildagliptín k predchádzajúcej monoterapii.

Priemerný vek účastníkov v štúdii bol 59 ± 8,7 rokov, BMI bolo 31,9 ± 5,1 kg/m2 a priemerná hodnota HbA1c bola 8,0 ± 1,3 %. Priemerné trvanie diabetu bolo 5,9 ± 4,8 rokov. Tab. 2 sumarizuje východiskové charakteristiky ITT populácie na Slovensku.
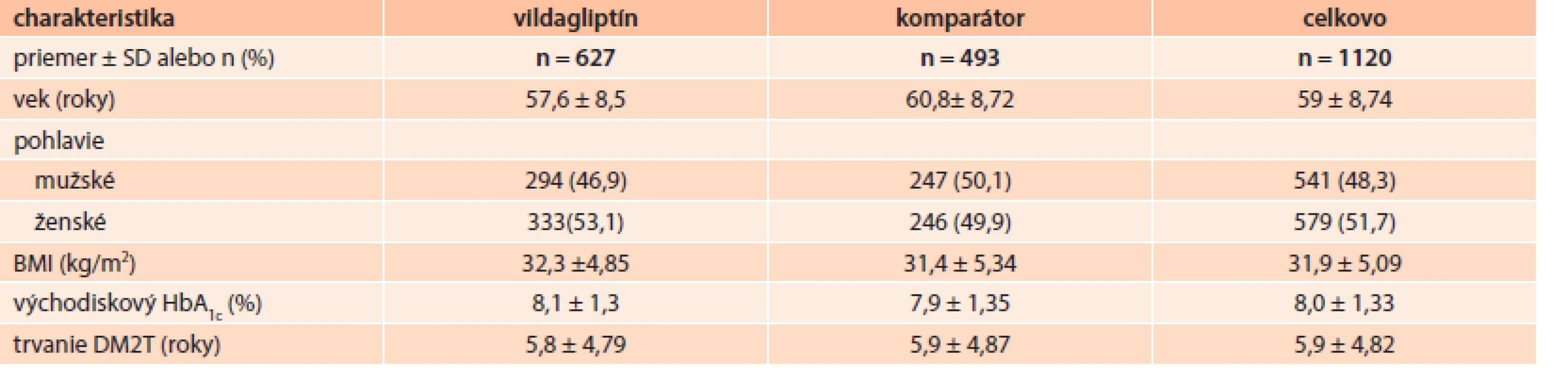
V kohorte s vildagliptínom bola väčšina pacientov (86 %) liečená kombináciou s metformínom a iba 13,6 % pacientov užívalo kombináciu vildagliptínu so sulfonylureou. V kohorte komparátora bola až 94 % pacientov liečených kombináciou metformínu so sulfonylureou. Tab. 3 uvádza indexovú liečbu u ITT populácie podľa kohorty.
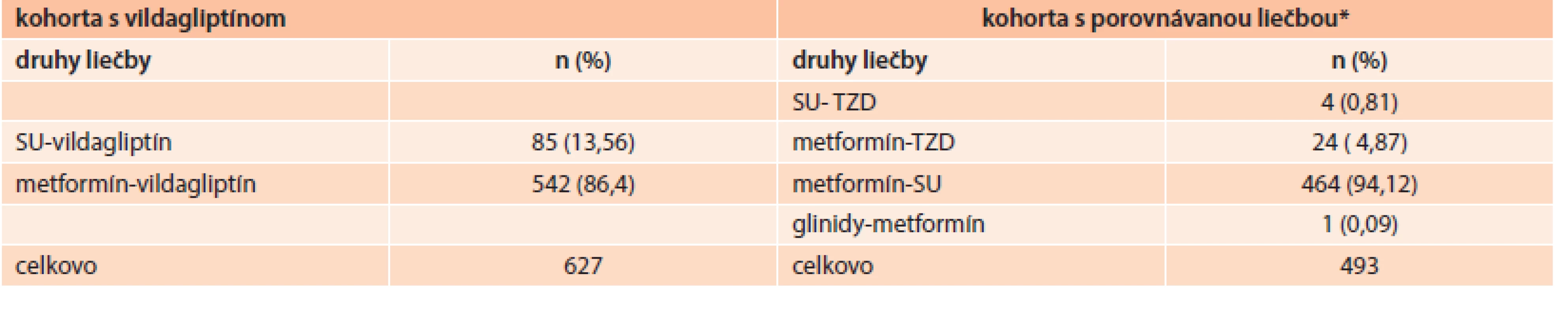
Na analýzu cieľových ukazovateľov účinnosti a znášanlivosti bola použitá PP populácia, ktorá mala na Slovensku rovnakú veľkosť ako ITT populácia, tvorilo ju 627 pacientov (56 %) v kohorte s vildagliptínom a 493 (44 %) pacientov v kohorte s komparátorom.
Primárne a sekundárne cieľové ukazovatele
Po pridaní druhého PAD, viac ako polovica všetkých liečených pacientov úspešne dosiahla PEP (57,1 % pacientov liečených vildagliptínom a 60,04 % pacientov liečených komparátorom), čo znamená OR (pomer šancí) 0,89 (95% CI [interval spoľahlivosti]: 0,70–1,13; p = 0,32) bez signifikantného rozdielu medzi skupinami. Trend v prospech liečby založenej na vildagliptíne sa pozoroval pri dosahovaní sekundárneho cieľového ukazovateľa (SEP) u pacientov s východiskovým HbA1c ≥7 %, (38,5 % pacientov liečených vildagliptínom v porovnaní s 33 % pacientov liečených komparátorom), OR 1,27 (95% CI: 0,97–1,66; p = 0,082), avšak bez dosiahnutia štatistickej významnosti. Tab. 4 uvádza analýzu primárneho (PEP) a sekundárneho cieľového ukazovateľa (SEP).
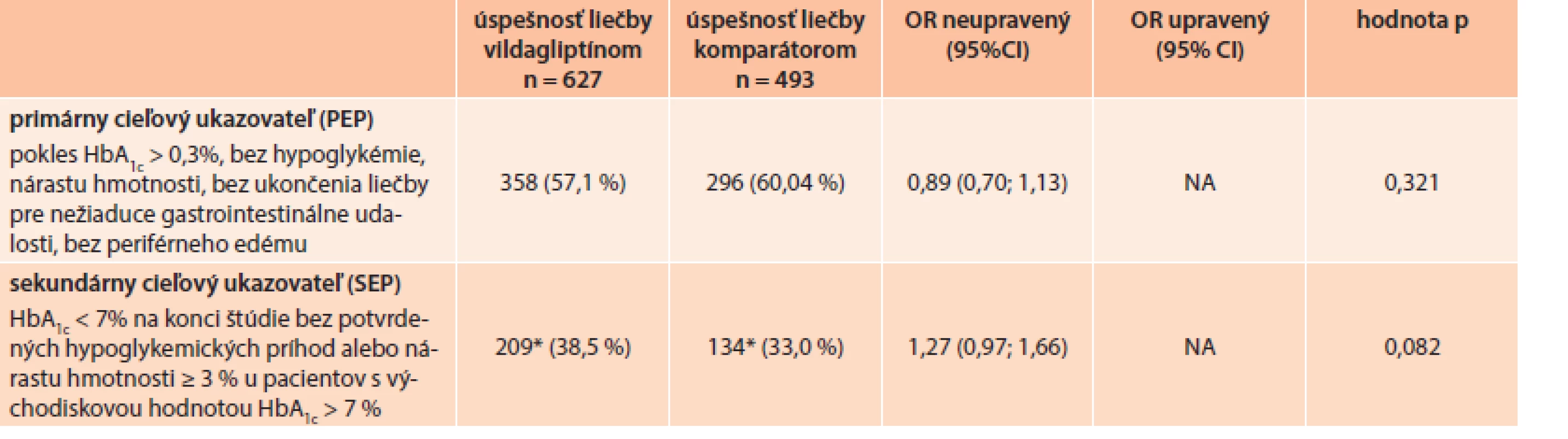
Analýza bezpečnosti
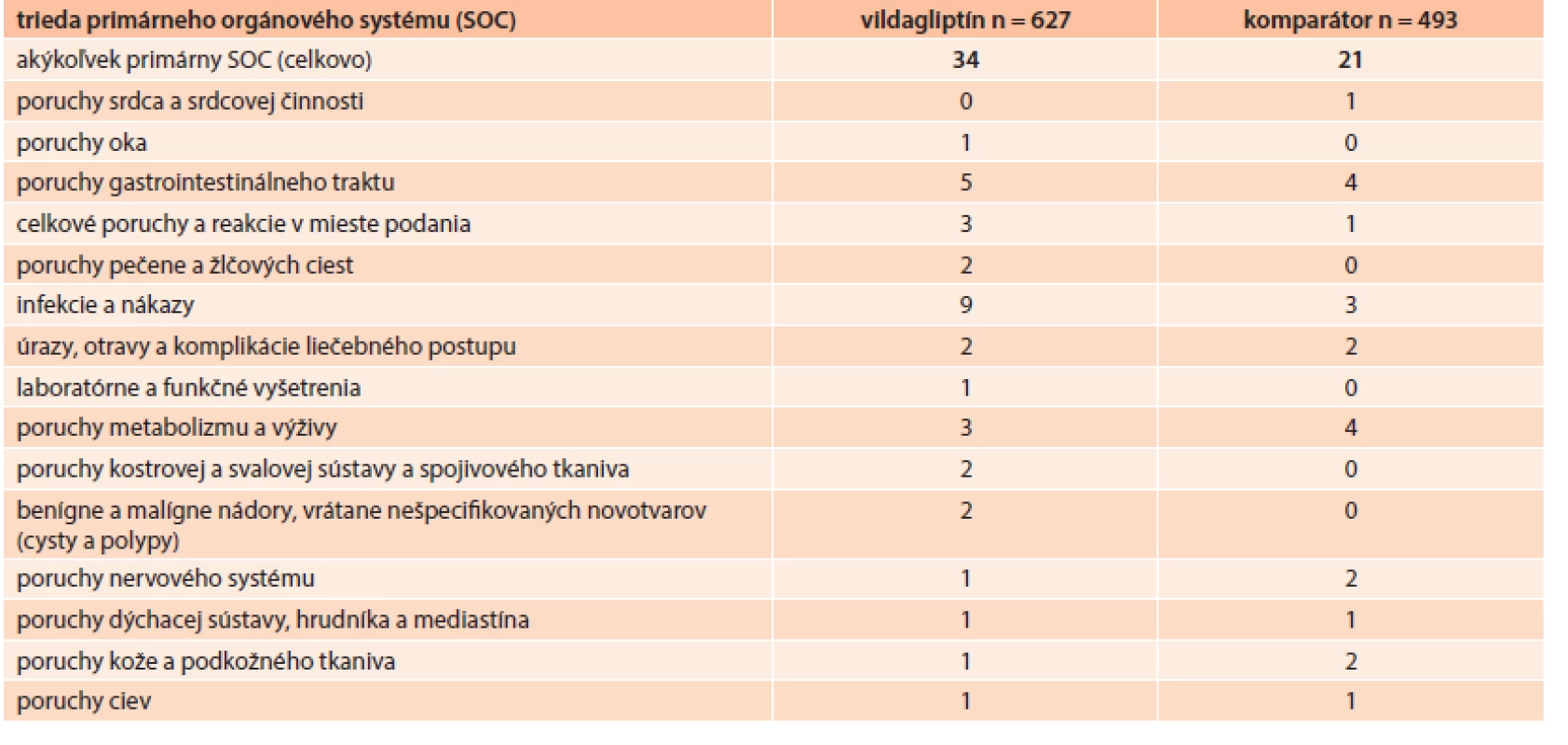
Percento pacientov s akýmikoľvek hlásenými nežiaducimi udalosťami (NU) bolo podobné v kohorte s vildagliptínom (4,9 %) a v porovnávanej kohorte (3,9 %). Tab. 5 sumarizuje nežiaduce udalosti, ktoré sa vyskytli počas štúdie a sú uvedené podľa tried orgánových systémov (SOC).
Celkovo boli hlásené 4 prípady závažných nežiaducich udalostí, 3 prípady v kohorte s vildagliptínom (0,5 %) a 1 prípad v porovnávanej kohorte (0,2 %). Ani v jednej z kohort neboli hlásené úmrtia. Tab. 6 sumarizuje závažné nežiaduce udalosti.

V kohorte s vildagliptínom nebola hlásená žiadna hypoglykémia, zatiaľ čo v porovnávanej skupine sa vyskytli 3 prípady (0,6 %) s celkovo 3 hypoglykemickými príhodami.
Diskusia
Diabetes mellitus 2. typu je progresívne ochorenie. Na udržanie dobrej glykemickej kompenzácie a predchádzanie neskorým komplikáciám je často potrebná kombinovaná liečba. Napriek prísnym kritériám pre vykonávanie randomizovaných kontrolovaných klinických skúšaní tieto skúšania poskytujú len limitované informácie o účinnosti nových liekov pre liečbu DM2T.
K dispozícii je len málo literárnych údajov z veľkých liekových štúdií v podmienkach reálnej klinickej praxe, ktoré by umožnili doplniť a porovnať údaje o účinnosti a bezpečnosti nových liekov, ktoré sa získali z randomizovaných kontrolovaných klinických skúšaní.
Významným zistením štúdie EDGE bolo potvrdenie globálne vysokej prevalencie suboptimálnej glykemickej kompenzácie u pacientov s DM2T, ktorí sú liečení monoterapiou PAD v podmienkach reálnej klinickej praxe (priemerná východisková hodnota HbA1c bola 8,0 %), napriek celosvetovým snahám o zdôraznenie dôležitosti dobrej glykemickej kompenzácie pri prevencii diabetických komplikácií [3]. Tieto údaje sú v súlade s údajmi z iných štúdií v Európe [2]. K suboptimálnej glykemickej kompenzácii môže prispievať množstvo faktorov ako napr. slabá adherencia pacientov k odporúčaným zmenám životného štýlu alebo obmedzený prístup k zdravotnej starostlivosti alebo nedostatok zdravotníckeho personálu, ale prispievať môže aj nedostatočné monitorovanie a intenzifikácia liečby.
Po pridaní druhého PAD viac ako polovica pacientov úspešne dosiahla PEP (odpoveď na liečbu, t.j. pokles HbA1c < 0,3 %, bez periférneho edému, hypoglykémie, prerušenia liečby pre nežiaduce gastrointestinálne účinky alebo pre nárast telesnej hmotnosti ≥ 5 %) bez významného rozdielu medzi skupinou s viladgliptínom a porovnávanou skupinou (u 94 % pacientov v porovnávanej skupine bola ako druhé PAD pridaná k metformínu sulfonylurea). Tento kombinovaný PEP sa zvolil na základe 2 faktorov, ktoré musia lekári brať do úvahy pri výbere optimálneho antidiabetika druhej línie, a to kombináciu účinnosti (tak ako je definovaná úradmi pre kontrolu liečiv) a najčastejších nežiaducich účinkov. Toto komplexné rozhodovanie sa takisto odráža v najnovších ADA-EASD smerniciach, ktoré odporúčajú zvažovať účinnosť a nežiaduce účinky, hlavne hypoglykémiu a nárast telesnej hmotnosti, pri rozhodovaní sa o optimálnej liečbe druhej voľby. V tomto kombinovanom primárnom cieľovom ukazovateli sa navyše zahrnuli aj najčastejšie nežiaduce účinky TZD a metformínu, a to najmä periférny edém a gastrointestinálne nežiaduce účinky.
SEP sa zameral iba na nežiaduce účinky zdôrazňované v ADA-EASD smerniciach a na klinicky akceptovateľný terapeutický cieľ. SEP definovaný ako podiel pacientov s východiskovou hodnotu HbA1c ≥ 7 %, ktorí dosiahli HbA1c < 7 % po 12 mesiacoch liečby bez nárastu telesnej hmotnosti ≥ 3 % alebo bez hypoglykémie dosiahlo na Slovensku 38,5 % pacientov v skupine s vildagliptínom a 33 % pacientov v porovnávanej kohorte (p = 0,08). Tieto výsledky sú porovnateľné s údajmi, ktoré sa preukázali v randomizovaných kontrolovaných klinických skúšaniach s vildagliptínom [10,11,12] a sú v súlade s výsledkami z celkovej populácie v rámci štúdie, kde sa SEP dosiahol u 35 % pacientov v skupine s vildagliptínom a u 23 % pacientov v porovnávanej skupine (p < 0,001).
Udalosti súvisiace s bezpečnosťou boli hlásené zriedkavo a profily bezpečnosti vildagliptínu a iných PAD boli v súlade s predchádzajúcimi údajmi [9]. Podobne ako v iných krajinách, výsledky štúdie EDGE na Slovensku potvrdili terapeutickú zotrvačnosť napriek najnovším smerniciam, ktoré zdôrazňujú včasnú intenzifikáciu antidiabetickej liečby.
Na Slovensku, v porovnaní s väčšinou ostatných krajín, boli pacienti zaraďovaní iba v špecializovaných diabetologických centrách, čo pozitívne ovplyvnilo kvalitu údajov a tiež množstvo chýbajúcich údajov. V dôsledku nedostatočnej zdrojovej dokumentácie alebo problémov s kvalitou/presnosťou zadávania údajov bol zo všetkých zaradených slovenských pacientov vylúčený iba jeden pacient (0,09 %). Kvalita údajov zo slovenských centier sa odrazila v tom, že PP populácia použitá na analýzu výsledných ukazovateľov účinnosti mala rovnakú veľkosť ako ITT populácia. Naopak veľkosť PP populácie v celkovej štúdii bola menšia ako veľkosť ITT populácie, u ktorej bol podiel ITT populácie zo všetkých 27 zúčastnených krajín 65 % (n=28 442) v skupine s vildagliptínom a 35 % (n=15 349) v porovnávanej skupine.
Porovnanie celkovej populácie so slovenskou kohortou preukázalo významný a dôležitý rozdiel v indexovej liečbe v porovnávanej skupine. Na Slovensku sa u väčšiny pacientov v porovnávanej skupine (94 %) k metformínu pridala sulfonylurea ako druhé PAD. Spomedzi pacientov v skupine s vildagliptínom sa väčšina liečila kombináciou s metformínom (86 %) a iba menšia časť (13,6 %) dostávala kombináciu vildagliptínu so sulfonylureou. Všetky tieto faktory ako aj menšia veľkosť vzorky mohli ovplyvniť výsledky PEP, ktorý nedosiahol štatistickú významnosť medzi dvomi porovnávanými skupinami pacientov na Slovensku. Na druhej strane výsledky celkovej populácie klinickej štúdie preukázali štatisticky významný prospech z liečby vildagliptínom, 55,4 % pacientov liečených týmto liekom dosiahlo PEP, zatiaľ čo v porovnávanej skupine to bolo iba 51,3 % pacientov, pričom hodnota OR bola 1,18 (95% CI: 1,13–1.22; p < 0,001).
Zisťovanie a hlásenie NU vychádzalo zo schémy dobrovoľného hlásenia, čo je najčastejšie používaná metóda na zisťovanie NU pre nové lieky v klinickej praxi [13,14]. Nežiaduce udalosti boli vo všeobecnosti zriedkavé, pravdepodobne nedostatočne hlásené v celkovej populácii ako aj na Slovensku. Z dôvodu malého počtu udalostí sa nevykonala štatistická analýza rozdielov medzi skupinami.
Obmedzenia štúdií realizovaných v podmienkach reálnej klinickej praxe takisto zvyčajne zahŕňajú nerovnováhu medzi ramenami liečby. Nezaslepený dizajn štúdie umožnil lekárom vybrať si akýkoľvek liek na základe ich klinického úsudku, čo malo za následok uprednostnenie nového lieku spoločnosti zadávajúcej štúdiu (627 pacientov na liečbe vildagliptínom vs 493 pacientov na porovnávaných liekoch).
Záver
Štúdie v podmienkach reálnej klinickej praxe poskytujú informácie, ktoré môžu dopĺňať údaje z randomizovaných kontrolovaných klinických skúšaní [11]. Údaje zo štúdie EDGE (slovenská kohorta štúdie) preukázali, že v prostredí reálnej klinickej praxe, keď sa pridalo druhé antidiabetikum, vyše polovica liečených pacientov úspešne dosiahla PEP, bez významných rozdielov medzi pacientmi v dvoch porovnávaných skupinách liečby. Aj v slovenskej kohorte štúdie sa preukázalo, že vildagliptín ako druhé PAD použité u pacientov s DM2T, ktorí nedosahovali cieľovú glykémiu pri monoterapii (SEP), môže účinne znížiť HbA1c na cieľových ≤7 % s dobrým profilom bezpečnosti. Tieto výsledky sú porovnateľné s údajmi preukázanými v randomizovaných kontrolovaných klinických skúšaniach s vildagliptínom [10,11,12] a sú v súlade s výsledkami z celkovej populácie v štúdii [9].
Prispievatelia
Všetci autori mali úplný prístup ku všetkým údajom a zodpovedajú za integritu týchto údajov a presnosť analýz.
Poďakovanie
Autori úprimne ďakujú lekárom a dobrovoľníkom, ktorí sa zúčastnili tejto štúdie.
Financovanie
Táto štúdia bola celá financovaná a monitorovaná spoločnosťou Novartis Pharma AG.
doc. MUDr. Katarína Rašlová, CSc.
metabolickecentrum@yahoo.com
Metabolické centrum doktorky Rašlovej, s.r.o.
www.metabolickecentrum.sk
MUDr. Dagmar Bucková
Doručené do redakcie 9. 9. 2014
Prijaté do tlače po recenzii 29. 9. 2014
Zdroje
1. Turner RC, Cull CA, Frighi V, et al. Glycemic control with diet, sulfonylurea, metformin, or insulin in patients with type 2 diabetes mellitus: progressive requirement multiple therapies (UKPDS 49). UK Prospective Diabetes Study (UKPDS) Group. JAMA 1999; 281(21):2005–2012.
2. Liebl A, Mata M, Eschwège E et al. Evaluation of risk factors for development of complications in Type II diabetes in Europe. Diabetologia 2002; 45(7): S23–28.
3. Inzucchi SE, Bergenstal RM, Buse JB et al. Management of hyperglycemia in type 2 diabetes: a patient-centered approach: position statement of the American Diabetes Association (ADA) and the European Association for the Study of Diabetes (EASD). Diabetes Care 2012; 35(6): 1364–1379.
4. Schwartz D, Lellouch J. Explanatory and pragmatic attitudes in therapeutical trials. J Clin Epidemiol 2009; 62(5): 499–505.
5. Treweek S, Zwarenstein M. Making trials matter: pragmatic and explanatory trials and the problem of applicability. Trials 2009; 10 : 37. Dostupné z DOI: <http://doi:10.1186/1745–6215–10–37>.
6. Ware JH, Hamel MB. Pragmatic trials-guides to better patient care? N Engl J Med 2011; 364(18): 1685–1687.
7. Mari A, Sallas WM, He YL et al. Vildagliptin, a dipeptidyl peptidase-IV inhibitor, improves model-assessed beta-cell function in patients with type 2 diabetes. J Clin Endocrinol Metab 2005; 90(8): 4888–4894.
8. Dejager S, Baron MA, Schweizer A. DPP-4 Inhibitors: review of vildagliptin phase 3 data. Rev Endocrinol 2007; 1(2): 47–51.
9. Mathieu C, Barnett A. H., Brath H et al. Effectiveness and tolerability of second-line therapy with vildagliptin vs. other oral agents in type 2 diabetes: A real-life worldwide observational study (EDGE). Int J Clin Pract 2013; 67(10): 947–956. Dostupné z DOI: <http://doi: 10.1111/ijcp.12252>.
10. Ferrannini E, Fonseca V, Zinman B et al. Fifty-two-week efficacy and safety of vildagliptin vs glimepiride in patients with type 2 diabetes mellitus inadequately controlled on metformin monotherapy. Diabetes Obes Metab 2009; 11(2): 157–166.
11. Filozof C, Gautier JF. A comparison of efficacy and safety of vildagliptin and gliclazide in combination with metformin in patients with Type 2 diabetes inadequately controlled with metformin alone: a 52-week, randomized study. Diabet Med 2010; 27(3): 318–326.
12. Garber AJ, Schweizer A, Baron MA et al. Vildagliptin in combination with pioglitazone improves glycaemic control in patients with type 2 diabetes failing thiazolidinedione monotherapy: a randomized, placebo-controlled study. Diabetes Obes Metab 2007; 9(2): 166–174.
13. Perez Garcia M, Figueras A. The lack of knowledge about the voluntary reporting system of adverse drug reactions as a major cause of underreporting: direct survey among health professionals. Pharmacoepidemiol Drug Saf 2011; 20(12): 1295–1302.
14. Hazell L, Shakir SA. Under-reporting of adverse drug reactions: a systematic review. Drug Saf 2006; 29(5): 385–396.
Štítky
Diabetologie Endokrinologie Interní lékařstvíČlánek vyšel v časopise
Forum Diabetologicum

2014 Číslo 3
-
Všechny články tohoto čísla
- Editorial
- Poruchy metabolizmu cukrů u Cushingova syndromu
- Osteoporóza a diabetes mellitus
- Diabetes mellitus a ochorenia štítnej žľazy
- Vitamín D a metabolický syndróm u žien so syndrómom polycystických ovárií
- Metabolický syndróm a pečeň
-
Účinnosť a znášanlivosť vildagliptínu ako lieku druhej voľby v porovnaní s inými perorálnymi antidiabetikami pri diabetes mellitus 2. typu
Celosvetová observačná štúdia v podmienkach reálnej klinickej praxe (EDGE – výsledky subanalýzy pacientov zaradených na Slovensku) - Asociácia srdcového zlyhávania Európskej kardiologickej spoločnosti
- Montpellierska lekárska škola
- Autodidaktický test hodnotený kreditmi SACCME
- Register kľúčových slov, autorov a lektorov
- Forum Diabetologicum
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle
- Diabetes mellitus a ochorenia štítnej žľazy
- Metabolický syndróm a pečeň
- Poruchy metabolizmu cukrů u Cushingova syndromu
- Osteoporóza a diabetes mellitus
