Chronická choroba obličiek u diabetikov 2. typu a závery štúdie EMPA-KIDNEY
Chronic kidney disease in type 2 diabetics and findings from the EMPA-KIDNEY study
Chronic kidney disease (CKD) is a frequent and serious complication in patients with type 2 diabetes mellitus, affecting 38 to 68% of patients according to data in the literature. In addition, the presence of CKD is associated with significantly higher morbidity and mortality rates and it also significantly complicates therapeutic approaches. As eGF values decrease and albuminuria increases, patient mortality from cardiovascular (CV) and other causes increases. It is therefore urgent for the diabetologist to address the issue of CKD both in terms of preventing its development (primary prevention) and slowing the progression of pre-existing CKD (secondary prevention), which involves intensive collaboration with a nephrologist. The EMPA-KIDNEY study, conducted in a population of patients with different causes of CKD, estimated glomerular filtration rate (eGF) and albuminuria levels, showed that treatment with empagliflozin, compared to placebo, contributed to a 28% reduction in the risk of CKD progression or death from CV causes, with no indications of significant safety issue. The benefit of empagliflozin treatment was demonstrated regardless of the presence or absence of diabetes and baseline eGF values. The outcomes were not influenced by CKD etiology (with the exception of a less convincing result in hypertensive/renovascular CKD), baseline HbA1c, the presence of previous CV disease or the use of RAASi at the time of randomization, which provides further support for a wider use of SGLT2i, also based on renal indication. However, the results of subgroup analyses showed that the effect of empagliflozin treatment was less evident in patients not receiving RAASi. Furthermore, the benefit of empagliflozin treatment was greater in patients with stage A3 albuminuria at the start of the study, whereas no significant difference between treatment with empagliflozin and placebo was observed in patients with normal or only mild albuminuria with a UACR of 30–300 mg/g, which was probably due to the lower risk of CKD progression in these patients. Finally, although the benefit of empagliflozin treatment was established independently of the presence / absence of diabetes mellitus, it was demonstrated to a lesser extent in patients without diabetes. These findings from the analyses of the effect of SGLT2i on CKD progression in relation to eGF, albuminuria, and the presence of diabetes, may therefore contribute to a more precise guidance on a more effective treatment as well as a better understanding of the mechanisms of renoprotection. In summary, we currently have three groups of drugs that have been proven to reduce the risk of progression of renal failure, each of them in a specific way. These groups involve the renin-angiotensin aldosterone system inhibitors (RAASi), the sodium-glucose cotransporter inhibitors (SGLT2i), and the non-steroidal mineralocorticoid receptor antagonist, finerenone. Empagliflozin is a drug from the SGLT2i group with the confirmed CV and renal benefit, making these drugs the preferred choice for the pharmacological treatment of DM2T, not only in patients with the already developed CV disease related to atherosclerosis, heart failure or CKD (secondary prevention), but also in patients receiving primary prevention. The EMPA-KIDNEY study provides further relevant evidence which significantly strengthens the preference for SGLT2i.
Keywords:
chronic kidney disease – CKD – empagliflosin – EMPA-KIDNEY
Authors:
Emil Martinka
Authors‘ workplace:
Národný endokrinologický a diabetologický ústav, n. o., Ľubochňa
Published in:
Forum Diab 2023; 12(1): 39-45
Category:
Overview
Chronická choroba obličiek (CKD – Chronic Kidney Disease) je u pacientov s diabetes mellitus 2. typu (DM2T) častá a závažná komplikácia, ktorá podľa údajov v literatúre postihuje 38 % až 68 % pacientov. Prítomnosť CKD sa okrem toho združuje s významne vyššou mierou morbidity aj mortality a významne sťažuje aj možnosti využívania terapeutických prístupov. S poklesom hodnoty odhadovanej glomerulárnej filtrácie (eGF – estimated Glomerular Filtration) a nárastom albuminúrie narastá úmrtnosť pacientov z kardiovaskulárnej (KV) ako aj akejkoľvek inej príčiny. Z uvedeného pre diabetológa preto vyplýva nutná potreba zaoberať sa problematikou CKD, a to tak z hľadiska prevencie jej vzniku (primárna prevencia), ako aj spomalenia progresie už jestvujúcej CKD (sekundárna prevencia), s čím súvisí aj intenzívna spolupráca s nefrológom. Štúdia EMPA-KIDNEY zrealizovaná na populácii pacientov so širokým spektrom príčin CKD, eGF ako aj hladín albuminúrie ukázala, že liečba empagliflozínom v porovnaní s placebom prispieva k redukcii rizika progresie CKD alebo úmrtia pre KV-príčinu o 28 %, bez signálu významnejšej bezpečnostnej obavy. Benefit liečby empagliflozínom sa pritom uplatňoval nezávisle od prítomnosti, resp. neprítomnosti diabetes mellitus a vstupných hodnôt eGF. Výsledky neovplyvňovala ani etiológia CKD (s výnimkou menej presvedčivého výsledku pri hypertenznej/renovaskulárnej CKD), vstupná hodnota HbA1c, prítomnosť predchádzajúceho KV-ochorenia (KVO) či použitie inhibítorov renín-angiotenzín-aldosterónového systému (RAASi) v čase randomizácie, čo prináša ďalšiu podporu pre širšie využívanie inhibítorov sodík-glukózového kotransportu (SGLT2i – Sodium-Glucose Cotransporter 2 inhibitors) aj z renálnej indikácie. Výsledky podskupinových analýz však poukázali, že u pacientov, ktorí nedostávali RAASi, bol efekt liečby empagliflozínom menej evidentný. Okrem toho, prínos liečby empagliflozínom bol väčší u pacientov s albuminúriou štádia A3 na začiatku štúdie, zatiaľ čo u pacientov s normálnou alebo len miernou albuminúriou 30–300 mg/g (UACR – Unit Albumine : Creatinine Ratio) sa rozdiel medzi liečbou empagliflozínom a placebom významnejšie nelíšil, čo pravdepodobne súviselo s nižším rizikom progresie CKD u týchto pacientov. A napokon, hoci sa benefit liečby empagliflozínom uplatňoval nezávisle od prítomnosti/ neprítomnosti diabetes mellitus, u pacientov bez diabetu sa uplatňoval v menšej miere. Tieto poznatky z analýz účinku SGLT2i na progresiu CKD v závislosti od eGF, albuminúrie a prítomnosti diabetu tak môžu prispieť k presnejšiemu návodu pre efektívnejšiu liečbu, ako aj zlepšeniu chápania mechanizmov renoprotekcie. V súčasnej dobe tak máme 3 skupiny farmák, ktoré preukázali zníženie rizika progresie zlyhania obličiek, naviac každý osobitným spôsobom. Týmito skupinami sú inhibítory renín-angiotenzín-aldosterónového systému (RAASi), inhibítori sodík-glukózového kotransportu (SGLT2i) a nesteroidný antagonista mineralokortikoidného receptora finerenon. Empagliflozín je farmakum zo skupiny SGLT2i s potvrdeným kardiovaskulárnym aj renálnym benefitom, vzhľadom k čomu sú tieto farmaká považované za preferenčný výber farmakologickej liečby DM2T, a to nielen u pacientov s už rozvinutým aterosklerózou podmieneným KVO, srdcovým zlyhávaním či CKD (sekundárna prevencia) ale aj u pacientov v primárnej prevencii. Štúdia EMPA-KIDNEY poskytuje ďalšie významné podklady, ktoré túto preferenciu SGLT2i významne posilňujú.
Klíčová slova:
empagliflozín – CKD – chronická choroba obličiek – EMPA-KIDNEY
Úvod
Chronická choroba obličiek (CKD – Chronic Kidney Disease) je u pacientov s diabetes mellitus 2. typu (DM2T) častá komplikácia. Podľa údajov v literatúre, v ktorej sa CKD definovala ako odhadovaná glomerulová filtrácia (eGF – estimated Glomerular Filtration) < 60 ml/min/1,73 m2 a/alebo albuminúria vo vyjadrení UACR (Urine Albumin-Creatinine Ratio/pomer albumínu a kreatinínu v moči) > 30 mg/g, sa pohybuje od 38 % do 68 % [1]. Na Slovensku bol podľa údajov štúdií NEFRITI na súbore 1 354 pacientov, resp. štúdie CARERA na súbore 5 683 pacientov podiel pacientov s CKD 39 %, resp. 38 % [2,3]. Prítomnosť CKD je nielen najčastejšou príčinou progresie do konečného štádia choroby obličiek (End Stage Kidney Disease – ESKD) [4–6] ale sa združuje aj s významne vyššou morbiditou aj mortalitou pacientov s DM2T a významne sťažuje aj terapeutické možnosti. S poklesom hodnoty eGF a nárastom albuminúrie narastá úmrtnosť pacientov z kardiovaskulárnej (KV) ako aj akejkoľvek inej príčiny [2,3,8,9,29].
Podľa literárnych údajov až 20 % pacientov s CKD má zároveň srdcové zlyhávanie (SZ) [7] s incidenciou 18/1 000 pacientov/rok [8]. A obrátene, až 49 % pacientov so SZ má súčasne CKD [9]. Prevalencia SZ s klesajúcimi funkciami obličiek narastá a trpí ním až 44 % dialyzovaných pacientov, pričom polovica z nich má redukovanú ejekčnú frakciu (EF) [10]. Prognóza pacientov so SZ a súčasne CKD je zlá a zhoršuje sa s klesajúcimi funkciami obličiek [9]. Aj podľa výsledkov slovenského prieskumu NEFRITI sa eGF < 30 ml/min/1,73 m2 v porovnaní s eGF > 60 ml/min/1,73 m2 spájala s 3 - až 10-násobne vyšším výskytom SZ, infarktu myokardu (IM), cievnej mozgovej príhody (CMP), s ochorením periférnych artérií, s amputáciami dolných končatín (DK) či potrebou revaskularizácie a 3 - až 5-krát vyšší bol aj výskyt úmrtia [2,3]. Napokon, CKD tiež spôsobuje zvýšenú mieru hospitalizácií a využívania zdravotnej starostlivosti, najmä nárokov na dialyzačnú a transplantačnú liečbu [11]. Z uvedeného pre diabetológa vyplýva nutná potreba zaoberať sa problematikou CKD, a to tak z hľadiska prevencie jej vzniku (primárna prevencia), ako aj spomalenia progresie už jestvujúcej CKD (sekundárna prevencia), s čím súvisí aj intenzívna spolupráca s nefrológom.
Na možnosť redukcie reziduálneho rizika CKD, ktoré pretrvávalo napriek liečbe inhibítormi renín-angiotenzín - aldosterónového systému (RAASi) považovanými za štandard liečby CKD, pridaním inhibítora sodík - glukózového kotransportu (SGLT2i) prvý krát poukázala štúdia EMPA-REG OUTCOME s empagliflozínom [12]. Táto štúdia však bola primárne dizajnovaná ako bezpečnostná kardiovaskulárna štúdia (CVOT – Cardiovascular Outcome Trial), ktorej úlohou bolo preukázať KV-bezpečnosť empagliflozínu. Štúdia potvrdila nielen KV-bezpečnosť, ale preukázala aj KV-benefit, ktorý spočíval najmä v redukcii kardiovaskulárnej a celkovej mortality, a to hlavne v súvislosti so zlepšením prognózy SZ. Ten sa prejavoval redukciou potreby hospitalizácie pre SZ. Následné analýzy štúdie poukázali aj na renálny benefit, ktorý spočíval v štatisticky významnej redukcii rizika novej nefropatie alebo jej zhoršenia od začiatku liečby, a to až o 39 %, definovanej ako kompozitný výsledok zložený z UACR > 300 mg/g, zdvojnásobenia hladiny kreatinínu v sére a eGF ≤ 45 ml/min, začiatok dialýzy, alebo úmrtie v dôsledku nefropatie. Empagliflozín tiež výrazne (9-krát) spomaľoval pokles eGF a preukázal KV-benefity aj u pacientov s CKD [13]. Podľa výsledkov ďalších analýz bol renálny benefit nezávislý od predošlej funkcie obličiek, a prejavil sa tak u pacientov s eGF < 60 ml/min/1,73 m2, resp. < 45 ml/min/1,73 m2, ako aj u pacientov s eGF > 60 ml/min/1,73 m2, resp. > 90 mol/ min/1,73 m2, ktorých bolo v štúdii zaradených viac ako 76 %. Podobne bol renálny benefit nezávislý aj od predošlej albuminúrie vyjadrenej ako UACR < 30 mg/g, resp. > 30 mg/g, ktorých bolo v štúdii zaradených viac ako 67 % [14]. Okrem toho, v analýzach empagliflozín znižoval nielen riziko makroalbuminúrie, ale aj mikroalbuminúrie [15], a to až o 30 %. Keďže v štúdii EMPA-REG OUTCOME boli renálne výsledky sekundárnym ukazovateľom, s cieľom získania presnejších odpovedí na renálny efekt empagliflozínu bola preto zrealizovaná štúdia EMPA-KIDNEY, ktorá bola navrhnutá tak, aby zhodnotila účinok liečby empagliflozínom na progresiu ochorenia obličiek a bezpečnosť liečby u pacientov s rôznymi príčinami už prítomnej CKD [16] s rôznymi hladinami eGF a UACR.
Štúdia EMPA-KIDNEY (Study of Heart and Kidney Protection with Empagliflozin)
Štúdia EMPA-KIDNEY bola randomizovaná dvojito zaslepená placebom kontrolovaná štúdia fázy III. Súbor účastníkov bol navrhnutý tak, aby umožnil hodnotiť účinky empagliflozínu na ukazovatele renálnych funkcií u pacientov s CKD rôznej etiológie, medzi ktorými boli nielen pacienti s DM2T, ale aj bez neho, ako aj pacienti s nízkymi hodnotami eGF a nízkymi hodnotami albuminúrie. Vylúčení boli pacienti s polycystickou chorobou obličiek a po transplantácii obličky. Do štúdie boli zaradení pacienti, ktorí mali v čase skríningu eGF > 20 ml/ min/1,73 m2, ale < 45 ml/min/1,73 m2 bez ohľadu na úroveň albuminúrie, alebo ktorí mali eGF > 45 ml/ min/1,73 m2, ale < 90 ml/min/1,73 m2 a súčasne UACR aspoň 200 mg/g. Pre výpočet eGF bol použitý vzorec podľa Chronic Kidney Disease Epidemiology Collaboration [22]. Štúdia prebiehala v 8 krajinách v 241 centrách. Hlavné inklúzne a exklúzne kritériá sú uvedené v tab. 1.
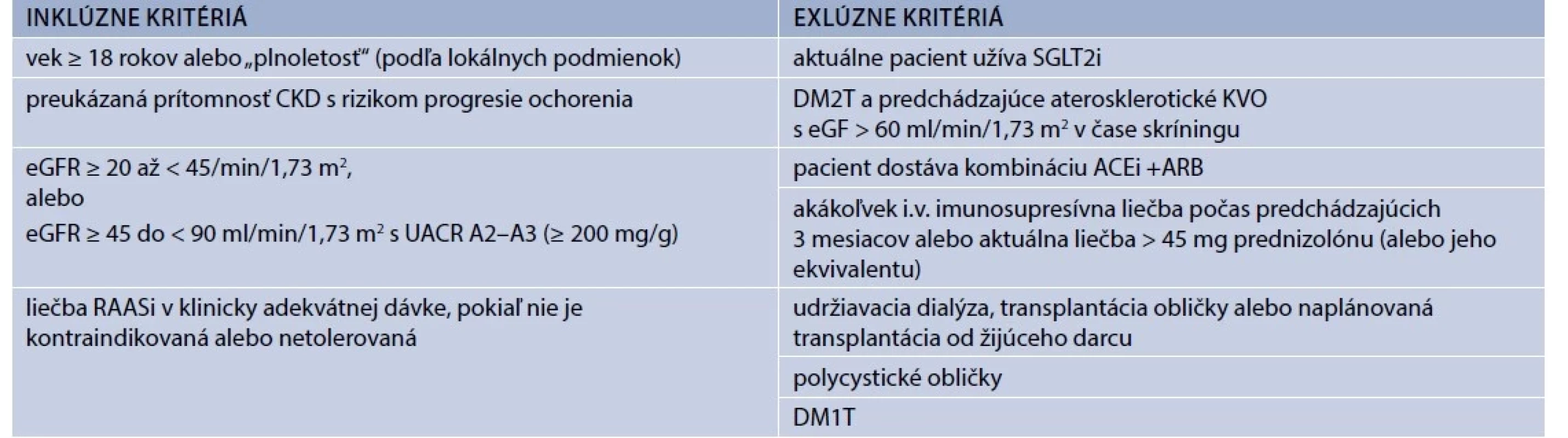
Od pacientov sa vyžadovalo, aby užívali RAASi v klinicky adekvátnej dávke. Zaradení však boli aj pacienti v prípade, že RAASi netolerovali, alebo mali kontraindikáciu pre jeho použitie. Pacienti spĺňajúci inklúzne a exklúzne kritériá boli najskôr zaradení do predrandomizačnej „run-in“ fázy v trvaní 15 týždňov, počas ktorej dostávali placebo. Následne boli randomizovaní pre liečbu empagliflozínom v dávke 10 mg 1-krát denne alebo placebom. Pri každej následnej návšteve sa od pacientov zhromažďovali informácie o stave ich obličiek (t.j. o akejkoľvek dialyzačnej liečbe alebo o transplantácii obličky), o dodržiavaní prideleného štúdiového terapeutického režimu (vrátane dôvodov prerušenia) a podrobnostiach o súbežnom užívaní liekov. Prostredníctvom štruktúrovanej anamnézy sa tiež zisťovali informácie týkajúce sa akýchkoľvek závažných nežiaducich účinkov (a protokolom špecifikovaných nezávažných nežiaducich účinkov a udalostí) a podrobili sa meraniu krvného tlaku, hmotnosti a odberu vzoriek krvi pre lokálne hodnotenie bezpečnosti hladín kreatinínu, funkcie pečene a hladiny draslíka. Vzorky moču (získané počas vybratých návštev) a vzorky krvi boli odoslané do centrálneho laboratória na analýzu účinnosti a na archiváciu.
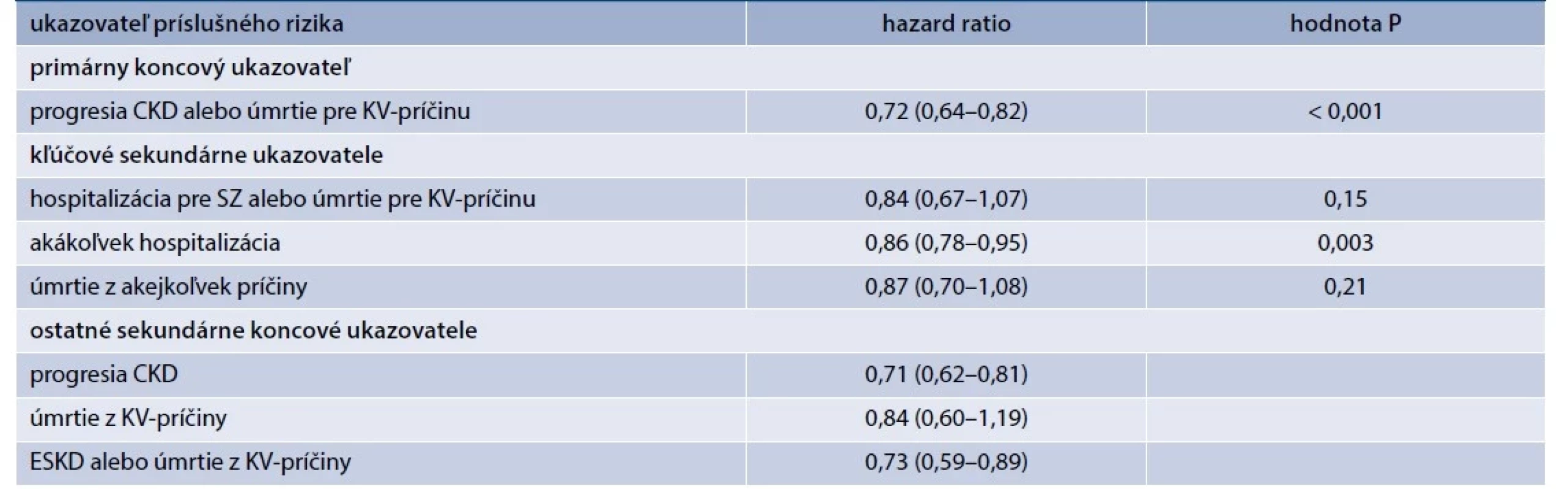
Primárny predšpecifikovaný koncový ukazovateľ zahŕňal progresiu CKD definovanú ako konečné štádium ochorenia obličiek (ESKD – end-stage kidney disease), začiatok dialýzy alebo transplantácia obličky, ďalej trvalý pokles eGF na < 10 ml/min/1,73 m2, trvalý pokles eGF o ≥ 40 % oproti východiskovej hodnote a úmrtie z renálnych príčin alebo úmrtie z KV-príčin.
Predšpecifikovaný sekundárny koncový ukazovateľ bol zložený z hospitalizácie pre SZ alebo úmrtie z KV-príčiny, z hospitalizácie z akejkoľvek príčiny zahŕňajúcej prvú a akúkoľvek následnú hospitalizáciu a úmrtie z akejkoľvek príčiny. Ďalšími sekundárnymi ukazovateľmi boli progresia CKD, úmrtie z KV-príčiny a zložený ukazovateľ tvorený ESKD alebo KV-úmrtím.
V priebehu približne 2 rokov bolo skríningom do štúdie zaradených 8 544 potenciálnych účastníkov. Z nich 8 184 pacientov (95,8 %) vstúpilo do predrandomizačej „run-in“ fázy a 6 609 sa zúčastnilo randomizácie.
V čase randomizácie bol priemerný vek pacientov 63,8 rokov, 33,2 % boli ženy a 54,0 % pacientov nemalo diabetes mellitus. Pacienti boli vo všeobecnosti reprezentatívnymi predstaviteľmi populácie pacientov s CKD s rizikom progresie ochorenia. Priemerná hodnota eGF bola 37,3 ± 14,5 ml/min/1,73 m2 a 34,5 % pacientov malo eGF < 30 ml/min/1,73 m2. Medián UACR bol 329 mg/g a 48,3 % pacientov malo UACR 300 mg/g alebo menej.
Štúdia bola dizajnovaná s predpokladom redukcie rizika primárneho ukazovateľa o 18 %. Bola však predčasne ukončená z etických dôvodov, a to pre veľmi priaznivé výsledky, keď nezávislý výbor pre monitorovanie údajov a bezpečnosti informoval, že v čase predbežnej analýzy na základe prvých 624 udalostí primárneho koncového ukazovateľa boli splnené obe podmienky pre predčasné ukončenie liečby na základe účinnosti. Sledovanie bolo ukončené v čase mediánu sledovania 2,0 roky (interkvartilný rozsah 1,5 až 2,4). Celkovo sledovanie v štúdii kompletne ukončilo alebo počas sledovania zomrelo 6 552 pacientov (99,1 %).
Počas sledovania sa progresia CKD alebo úmrtia z KV-príčin vyskytli u 432 z 3 304 pacientov (13,1 %) v skupine s empagliflozínom a u 558 pacientov z 3 305 pacientov (16,9 %) v skupine s placebom (HR 0,72; 95% CI 0,64–0,82; p < 0,001). Výsledky štúdie teda preukázali významnú redukciu primárneho koncového ukazovateľa o 28 % a boli konzistentné nezávisle od prítomnosti DM2T ako aj medzi podskupinami definovanými podľa vstupnej hodnoty eGF (< 30, 30–45 a > 45 ml/min/1,73 m2). V rámci kľúčových sekundárnych ukazovateľov došlo k významnej redukcii o 14 % aj pri hospitalizáciách z akejkoľvek príčiny, keď miera prvej a následných hospitalizácií z akejkoľvek príčiny bola v skupine s empagliflozínom v porovnaní s placebom nižšia (24,8 vs 29,2 hospitalizácií na 100 pacient-rokov), s HR 0,86; 95% CI 0,78–0,95; p = 0,003). Rozdiel však nebol zistený v sekundárnom kľúčovom koncovom ukazovateli zloženom z hospitalizácie pre SZ alebo úmrtie z KV-príčiny, ktorý sa v skupine s empagliflozínom vyskytol u 4,0 % pacientov a v skupine s placebom u 4,6 % pacientov s HR 0,84; 95 % CI, 0,67–1,07; p = 0,15) ani v úmrtí z akejkoľvek príčiny (4,5 % vs 5,1 %, HR 0,87; 95% CI 0,70–1,08; p = 0,21), tab. 2, a rozdiel nebol zistený ani pri samostatnom ukazovateli úmrtia pre KV-príčinu (HR 0,84; 95% CI 0,60 – 1,19), zaradenom medzi ostatné sekundárne koncové ukazovateľa (tab. 2). Táto diskrepancia oproti výsledkom z predošlých štúdií mohla súvisieť s nižším než očakávaným počtom KV-príhod, čo limitovalo aj štatistickú silu pre vyhodnotenie sekundárnych KV-koncových ukazovateľov. V rámci ostatných sekundárnych koncových ukazovateľov bol v skupine s empagliflozínom v porovnaní s placebom signifikantný efekt redukcie rizika progresie CKD aj samostatne (HR 0,71; 95% CI 0,62–0,81) a signifikantný efekt na koncový ukazovateľ zložený z ESKD alebo úmrtia pre KV-príčinu s HR 0,73; 95% CI 0,59–0,89. Analýza sekundárnych ukazovateľov preukázala tiež redukciu v ESKD, v pretrvávaní eGF < 10 ml/min/1,73 m2, pretrvávaní poklesu eGF ≥ 40 % od randomizácie, či akejkoľvek progresie ochorenia obličiek (tab. 2).
Okrem prítomnosti/neprítomnosti DM2T a vstupných hodnôt eGF výsledky neovplyvňovala ani etiológia CKD (s výnimkou menej presvedčivého výsledku pri hypertenznej/ renovaskulárnej CKD), vstupná hodnota HbA1c, prítomnosť predchádzajúceho KVO či použitie RAASi v čase randomizácie. Výsledky podskupinových analýz však poukázali, že u pacientov, ktorí nedostávali RAASi, bol efekt liečby empagliflozínom na primárny koncový ukazovateľ menej evidentný [21,23]. Okrem toho, prínos liečby empagliflozínom na primárny koncový ukazovateľ bol väčší u pacientov s albuminúriou štádia A3 (UACR > 300 mg/g) na začiatku štúdie, zatiaľ čo u pacientov s normálnou alebo len miernou albuminúriou s UACR 30–300 mg/g sa rozdiel medzi liečbou empagliflozínom a placebom významnejšie nelíšil, čo pravdepodobne súviselo s nižším rizikom progresie CKD u týchto pacientov. Predšpecifikovaná exploratívna analýza ročnej miery zmeny eGF, čo je akceptovaný marker progresie renálneho ochorenia [24], však ukázala, že empagliflozín spomalil mieru dlhodobého poklesu eGF aj u pacientov so vstupnou hodnotou UACR < 300 mg/g, a to vrátane pacientov s UACR < 30 mg/g [21,23]. A napokon, hoci sa benefit liečby empagliflozínom na primárny koncový ukazovateľ uplatňoval nezávisle od prítomnosti/ neprítomnosti diabetes mellitus, u pacientov s DM2T sa uplatňoval vo väčšej miere [21,23]. Tieto poznatky z analýz účinku SGLT2i na progresiu CKD v závislosti od eGF, albuminúrie a prítomnosti diabetu tak môžu prispieť k presnejšiemu návodu pre efektívnejšiu liečbu, ako aj zlepšeniu chápania mechanizmov renoprotekcie [21].
Nebolo preukázané, že by liečba empagliflozínom zvyšovala incidenciu závažných nežiaducich účinkov celkovo ani v rámci orgánových systémov. Ketoacidóza sa objavila u 6 pacientov pri liečbe empagliflozínom a u 1 pacienta v skupine s placebom (0,09 a 0,02 príhody na 100 pacient - rokov). K amputáciám na dolných končatinách došlo u 28 pacientov v skupine s empagliflozínom a u 19 pacientov v skupine s placebom (0,43 a 0,29 príhody na 100 pacient-rokov). Incidencia závažných infekcií močového traktu, hyperkalémia, akútne poškodenie obličiek, závažná alebo symptomatická dehydratácia, poškodenie pečene a zlomeniny kostí boli medzi skupinami podobné.
Efekt SGLT2-inhibície na progresiu ochorenia obličiek alebo úmrtie z KV-príčin v štúdii EMPA-KIDNEY bol kvantitatívne podobný ako v predošlých 2 veľkých placebom kontrolovaných štúdiách, ktoré zahŕňali pacientov s CKD [17,18]. V dizajne štúdií však bolo niekoľko významných odlišností.
V štúdii s kanagliflozínom The Canagliflozin and Renal Events in Diabetes with Established Nephropathy Clinical Evaluation (CREDENCE) boli zaradení iba pacienti s DM2T a UACR minimálne 300 mg/g. Naviac, pacienti s eGF < 30 ml/min/1,73 m2 boli z účasti vylúčení [17].
V štúdii s dapagliflozínom The Dapagliflozin and Prevention of Adverse Outcomes in Chronic Kidney Disease (DAPA-CKD) sa zas vyžadoval UACR aspoň 200 mg/g a eGF 25–75 ml/min/1,73 m2. Okrem toho, štúdia DAPA-CKD zahŕňala 1 398 účastníkov bez diabetu a 624 účastníkov s eGF < 30 ml/min/1,73 m2 [7], čo je významne menej než v štúdii EMPA-KIDNEY. A obmedzená bola aj odpoveď na otázku, či a ako sa tieto prínosy môžu líšiť medzi širšou populáciou pacientov s CKD [18–20].
Zásadným prínosom štúdie EMPA-KIDNEY k jestvujúcim dôkazom je teda preukázanie konzistentného benefitu na skupine až 3 569 pacientov (54,0 % pacientov v štúdii) bez diabetu a spomedzi nich na skupine 2 282 pacientov (34,5 %) s eGF < 30 ml/min/1,73 m2. Napriek zahrnutiu až 3 192 pacientov s UACR < 300 mg/g bol počet príhod primárneho cieľa medzi týmito pacientmi limitovaný a CKD u nich progredovala pomalšie než u pacientov s UACR 300 mg/g a viac. Silnou stránkou štúdie EMPA-KIDNEY bol tiež počet pacientov a relatívne široké vstupné kritériá, vysoká miera adherencie počas štúdie a takmer kompletné dosledovanie pacientov. Limitáciami štúdie bol nižší než očakávaný počet KV-príhod, ktorý limitoval aj štatistickú silu pre vyhodnotenie sekundárnych a terciárnych KV-koncových ukazovateľov.
Záver
Chronická choroba obličiek (CKD) je u pacientov s DM2T častá a závažná komplikácia, ktorá podľa údajov v literatúre postihuje 38–68 % pacientov. Prítomnosť CKD sa okrem toho združuje s významne vyššou mierou morbidity aj mortality a významne sťažuje aj možnosti využívania terapeutických prístupov. S poklesom hodnoty eGF a nárastom albuminúrie narastá úmrtnosť pacientov z kardiovaskulárnej ako aj akejkoľvek inej príčiny. Z uvedeného pre diabetológa preto vyplýva nutná potreba zaoberať sa problematikou CKD, a to tak z hľadiska prevencie jej vzniku (primárna prevencia), ako aj spomalenia progresie už jestvujúcej CKD (sekundárna prevencia), s čím súvisí aj intenzívna spolupráca s nefrológom.
Štúdia EMPA-KIDNEY zrealizovaná na populácii pacientov so širokým spektrom príčin CKD, odhadovanej glomerulárnej filtrácie (eGF) ako aj hladín albuminúrie ukázala, že liečba empagliflozínom v porovnaní s placebom prispieva k redukcii rizika progresie CKD alebo úmrtia pre KV-príčinu o 28 %, bez signálu významnejšej bezpečnostnej obavy. Benefit liečby empagliflozínom sa pritom uplatňoval nezávisle od prítomnosti, resp. neprítomnosti diabetes mellitus a vstupných hodnôt eGF. Výsledky neovplyvňovala ani etiológia CKD (s výnimkou menej presvedčivého výsledku pri hypertenznej/renovaskulárnej CKD), vstupná hodnota HbA1c, prítomnosť predchádzajúceho KVO či použitie RAASi v čase randomizácie, čo prináša ďalšiu podporu pre širšie využívanie SGLT2i aj z renálnej indikácie. Výsledky podskupinových analýz však poukázali, že u pacientov, ktorí nedostávali RAASi bol efekt liečby empagliflozínom menej evidentný [21]. Okrem toho, prínos liečby empagliflozínom bol väčší u pacientov s albuminúriou štádia A3 na začiatku štúdie, zatiaľ čo u pacientov s normálnou alebo len miernou albuminúriou s UACR 30–300 mg/g sa rozdiel medzi liečbou empagliflozínom a placebom významnejšie nelíšil, čo pravdepodobne súviselo s nižším rizikom progresie CKD u týchto pacientov. A napokon, hoci sa benefit liečby empagliflozínom uplatňoval nezávisle od prítomnosti/neprítomnosti diabetes mellitus, u pacientov bez diabetu sa uplatňoval v menšej miere. Tieto poznatky z analýz účinku SGLT2i na progresiu CKD v závislosti od eGF, albuminúrie a prítomnosti diabetu tak môžu prispieť k presnejšiemu návodu pre efektívnejšiu liečbu, ako aj zlepšeniu chápania mechanizmov renoprotekcie [21].
V súčasnej dobe tak máme 3 skupiny farmák, ktoré preukázali zníženie rizika progresie zlyhania obličiek, naviac každý osobitným spôsobom. Týmito skupinami sú inhibítory renín-angiotenzín aldosterónového systému (RAASi) [24–26], inhibítori sodík-glukózového kotransportu (SGLT2i) [17,18] a nesteroidný antagonista mineralokortikoidného receptora finerenon [27,28]. Empagliflozín je farmakum zo skupiny SGLT2i s potvrdeným kardiovaskulárnym aj renálnym benefitom, vzhľadom k čomu sú tieto farmaká považované za preferenčný výber farmakologickej liečby DM2T, a to nielen u pacientov s už rozvinutým aterosklerózou podmieneným KVO, srdcovým zlyhávaním či CKD (sekundárna prevencia), ale aj u pacientov v primárnej prevencii. Štúdia EMPA-KIDNEY poskytuje ďalšie významné podklady, ktoré túto preferenciu SGLT2i významne posilňujú.
doc. MUDr. Emil Martinka, PhD.
www.nedu.sk
Doručené do redakcie | Received 13. 2. 2023
Prijaté po recenzii | Accepted 13. 3. 2023
Sources
1. Cooper ME, Brownlee M, Susztak K et al. Diabetic kidney disease Nat Rev Dis Primers 2015; 1 : 15018. Dostupné z DOI: <http://dx.doi.org/10.1038/nrdp.2015.18>.
2. Martinka E. Kardiovaskulárna morbidita a mortalita pacientov s diabetes mellitus 2. typu na Slovensku: výsledky štúdie NEFRITI II. Edukačný portál SDiA 2019. Dostupné z WWW: <http:// www.lekar.sdia.sk/sdia-lekarske-profesne-zdruzenie-aktuality/170/kardiovaskularna-morbidita-a-mortalita-pacientov-s-diabetes-mellitus-2-typu-na-slovensku-vysledky-studie-nefriti-ii/>.
3. Martinka E. CARERA (CArdiovascular and REnal Risk Assessment): prieskum kardiovaskulárneho rizika u pacientov s diabetes mellitus 2. typu na Slovensku. Dostupné z WWW: <http:// www.lekar.sdia.sk/sdia-lekarske-profesne-zdruzenie-aktuality/33/carera-cardiovascular-and-renal-risk-assessment-prieskum-kardiovaskularneho-rizika-u-pacientov-s-diabetes-mellitus-2-typu-na-lovensku/>.
4. Thomas MC, Cooper ME, Zimmet P. Changing epidemiology of type 2 diabetes mellitus and associated chronic kidney disease. Nat Rev Nephrol 2016; 12(2): 73–81. Dostupné z DOI: <http://dx.doi.org/10.1038/nrneph.2015.173>.
5. Toth-Manikowski S, Atta MG. Diabetic Kidney Disease: Pathophysiology and Therapeutic Targets. J Diabetes Res 2015; 2015 : 697010. Dostupné z DOI: <http://dx.doi.org/10.1155/2015/697010>.
6. Stewart JH, McCredie MR, Williams SM et al. Trends in incidence of treated end‐stage renal disease, overall and by primary renal disease, in persons aged 20–64 years in Europe, Canada and the Asia‐Pacific region, 1998–2002. Nephrology (Carlton) 2007; 12(5): 520–527. Dostupné z DOI: <http://dx.doi.org/10.1111/j.1440–1797.2007.00830.x>.
7. Jager KJ, Kovesdy C, Langham R et al. A single number for advocacy and communication-worldwide more than 850 million individuals have kidney diseases. Nephrol Dial Transplant 2019; 34(11): 1803–1805. Dostupné z DOI: <http://dx.doi.org/10.1093/ndt/gfz174>.
8. Kottgen A, Russell SD, Loehr LR et al. Reduced kidney function as a risk factor for incident heart failure: The Atherosclerosis Risk in Communities (ARIC) study. J Am Soc Nephrol 2007; 18(4): 1307–1315. Dostupné z DOI: <http://dx.doi.org/10.1681/ASN.2006101159>.
9. Damman K, Valente MA, Voors AA et al. Renal impairment, worsening renal function, and outcome in patients with heart failure: An updated meta-analysis. Eur Heart J 2014; 35(7): 455–469. Dostupné z DOI: <http://dx.doi.org/10.1093/eurheartj/eht386>.
10. House AA, Wanner C, Sarnak MJ et al. [Conference Participants]. Heart failure in chronic kidney disease: Conclusions from a Kidney Disease: Improving Global Outcomes (KDIGO) Controversies Conference. Kidney Int 2019; 95(6): 1304–1317. Dostupné z DOI: <http://dx.doi.org/10.1016/j.kint.2019.02.022>.
11. United States Renal Data System. 2021 USRDS Annual Data Report. 2021. Dostupné z WWW: <https://adr.usrds.org/2021>. [10–2022].
12. Zinman B, Wanner Ch, Lachin JM et al. [EMPA-REG OUTCOME Investigators]. Empagliflozin, Cardiovascular Outcomes, and Mortality in Type 2 Diabetes. N Engl J Med 2015; 373(22): 2117–2128. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJMoa1504720>.
13. Wanner C, Inzucchi SE, Lachin JM et al. [EMPA-REG OUTCOME Investigators]. Empagliflozin and Progression of Kidney Disease in Type 2 Diabetes. N Engl J Med 2016; 375(4): 323–334. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJMoa1515920>.
14. Herrington WG, Preiss D, Haynes R et al. The potential for improving cardiorenal outcomes by sodium-glucose cotransporter-2 inhibition in people with chronic kidney disease: a rationale for the EMPA-KIDNEY study. Clin Kidney J 2018; 11(6):749–761 Dostupné z DOI: <http://dx.doi.org/10.1093/ckj/sfy090>.
15. Cherney DZ, Inzucchi SE, Zinman B et al. Effects of empagliflozin on the urinary albumin-to-creatinine ratio in patients with type 2 diabetes and established cardiovascular disease: an exploratory analysis from the EMPA-REG OUTCOME randomised, placebo-controlled trial. Lancet Diabetes Endocrinol 2017; 5(8): 610–621. Dostupné z DOI: <http://dx.doi.org/10.1016/S2213–587(17)30182–1>.
16. Herrington WG, Staplin N, Wanner C et al. [EMPA-KIDNEY Collaborative Group]. Empagliflozin in Patients with Chronic Kidney Disease. N Engl J Med 2023; 388(2): 117–127. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJMoa2204233>.
17. Perkovic V, Jardine MJ, Neal B et al. [CREDENCE Trial Investigators]. Canagliflozin and renal outcomes in type 2 diabetes and nephropathy. N Engl J Med 2019; 380(24): 2295–2306. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJMoa1811744>.
18. Heerspink HJ, Stefánsson BV, CorreaRotter R et al. Dapagliflozin in patients with chronic kidney disease. N Engl J Med 2020; 383(15): 1436–46. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJMoa2024816>-
19. Wheeler DC, Stefánsson BV, Jongs N et al. Effects of dapagliflozin on major adverse kidney and cardiovascular events in patients with diabetic and non-diabetic chronic kidney disease: a prespecified analysis from the DAPA-CKD trial. Lancet Diabetes Endocrinol 2021; 9(1): 22–31. Dostupné z DOI: <http://dx.doi.dx.org/10.1016/S2213–8587(20)30369–7>.
20. Staplin N, Haynes R, Mayne K et al. [Nuffield Department of Population Health Renal Studies Group; SGLT2 inhibitor Meta-Analysis Cardio-Renal Trialists’ Consortium]. Impact of diabetes on the effects of sodium glucose cotransporter-2 (SGLT2) inhibitors on kidney outcomes: collaborative meta-analysis of large placebo-controlled trials. Lancet 2022; 400(10365): 1788–1801. Dostupné z DOI: <http://dx.doi.org/10.1016/S0140–6736(22)02074–8>.
21. August P. Chronic Kidney Disease — Another Step Forward. N Engl J Med 2023; 388(2): 179–180. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJMe2215286>.
22. Levey AS, Stevens LA, Schmid CH et al. A new equation to estimate glomerular filtration rate. Ann Intern Med 2009; 150(9): 604–612. Dostupné z DOI: <http://dx.doi.org/10.7326/0003–4819–150–9-200905050–00006>.
23. Herrington WG, Staplin N, Wanner C et al. [EMPA-KIDNEY Collaborative Group]. Empagliflozin in patients with chronic kidney disease. N Engl J Med 2023; 388(2): 117–127. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJMoa2204233>.
24. Brenner BM, Cooper ME, de Zeeuw D et al. Effects of losartan on renal and cardiovascular outcomes in patients with type 2 diabetes and nephropathy. N Engl J Med 2001; 345(12): 861–869. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJMoa011161>.
25. Lewis EJ, Hunsicker LG, Clarke WR et al. Renoprotective effect of the angiotensin-receptor antagonist irbesartan in patients with nephropathy due to type 2 diabetes. N Engl J Med 2001; 345(12): 851–860. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJMoa011303>.
26. Lewis EJ, Hunsicker LG, Bain RP et al. The effect of angiotensin-converting-enzyme inhibition on diabetic nephropathy. N Engl J Med 1993; 329(20): 1456–1462. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJM199311113292004>.
27. Bakris GL, Agarwal R, Anker SD et al. Effect of finerenone on chronic kidney disease outcomes in type 2 diabetes. N Engl J Med 2020; 383(23): 2219–2229. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJMoa2025845>.
28. Pitt B, Filippatos G, Agarwal R et al. Cardiovascular events with finerenone in kidney disease and type 2 diabetes. N Engl J Med 2021; 385(24): 2252–2263. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJMoa2110956>.
29. Fox CS, Matsushita K, Woodward M et al. Chronic Kidney Disease Prognosis Consortium. Associations of kidney disease measures with mortality and end-stage renal disease in individuals with and without diabetes: a meta-analysis. Lancet 2012; 380(9854):1662–1673. Dostupné z DOI: <http://doi: 10.1016/S0140-6736(12)61350-6>. Erratum in: Lancet 2013; 381(9864): 374. PMID: 23013602; PMCID: PMC3771350.
Labels
Diabetology Endocrinology Internal medicineArticle was published in
Forum Diabetologicum

2023 Issue 1
Most read in this issue
- Prescription of alfa-lipoic acid to the patients with diabetic neuropathy in accordance with evidence-based medicine
- Specifics of pharmacotherapy in obese patients
- Psychological care for patients before and after bariatric/metabolic surgery
- Obesity as a cause of cardio-nephro-hepato-metabolic diseases
